- INFORMATIONS MEDICALES QUOTIDIENNES DANS LE MONDE
- PREVENIR LA PERTE DE VISION AVEC UNE ALIMENTATION SAINE; LES ALIMENTS QUE VOUS DEVRIEZ MANGER
- COMMENT PRENDRE SOIN D'UNE PERSONNE GRIPPEE: SOINS ET TRAITEMENT A DOMICILE
- QUE FAIRE SI VOUS PENSEZ QUE VOUS OU QUELQU'UN QUI VIT AVEC VOUS A COVID-19
- SE LAVER LES MAINS POURRAIT ETRE UN PROBLEME POUR DES MILLIONS D'AMERICAINS: VOICI POURQUOI
- VOUS VOULEZ BOOSTER VOTRE IMMUNITE? PENSEZ A AJOUTER DE LA CITRONNELLE A VOTRE ALIMENTATION
- ÉTUDE : AU MOINS 400 000 PERSONNES EN AMERIQUE SONT MORTES DE « VACCINS » CONTRE LE COVID
- QUE FAIRE EN CAS DE NEZ QUI COULE
- 14 REMEDES POUR RESTAURER LA PERTE DE GOUT ET D'ODEUR - RETROUVEZ-LE DE MANIERE NATURELLE !
- LA FDA AJOUTE 20 ANS SUPPLEMENTAIRES AU CALENDRIER POUR LA PUBLICATION COMPLETE DES DONNEES DU VACCIN PFIZER
- DES RESPONSABLES DU NIH ONT TRAVAILLÉ AVEC ECOHEALTH ALLIANCE
- UN MEDECIN ALLEMAND A ETE ASSASSINE QUELQUES HEURES APRES AVOIR EXPOSE DE L'HYDROXYDE DE GRAPHENE DANS DES VACCINS
- L'AUTRICHE EST LE PREMIER PAYS OCCIDENTAL A IMPOSER DES "VACCINS" CONTRE LE COVID A TOUS SES CITOYENS
- L'AGENCE BRITANNIQUE DE SECURITE SANITAIRE PUBLIE DES DONNEES
- LISTE DES MEILLEURS EXERCICES COMPLETS DU CORPS
- DR ROBERT MALONE : « LES VACCINES SONT EN FAIT CEUX QUI CREENT LE PLUS DE RISQUES POUR TOUT LE MONDE »
- PLUS DE PERSONNES SONT MORTES DANS L'ESSAI CLINIQUE CLE DU VACCIN COVID
- UNE VENTILATION SIMPLE DES INGREDIENTS DANS LES VACCINS COVID
- LES VACCINES MEURENT A LA VUE DE TOUS ALORS QUE FAUCI ET LES MEDIAS ADMETTENT UN ÉCHEC TOTAL DES VACCINS...
- UN LANCEUR D'ALERTE REVELE L'ADMISSION A L'HOPITAL AVEC 90 % DE PATIENTS VACCINES
- RISQUE INCONNU : PFIZER ADMET QUE DAVANTAGE D'ETUDES SONT NECESSAIRES SUR LE RISQUE DE MYOCARDITE
- LES NOUVEAUX NAZIS : L'AUTRICHE ORDONNE LE CONFINEMENT DU COVID POUR 2 MILLIONS DE CITOYENS NON VACCINES
- BILL GATES AVEC DES ACTIONS IMPORTANTES DANS PFIZER
- LA TESTOSTERONE COMME ALTERNATIVE POSSIBLE A LA CHIRURGIE DE PERTE DE POIDS
- LES CHIFFRES DERRIERE L'OBESITE
- COMMENT L'ALCOOL CAUSE-T-IL LE CANCER?
- QUELS THERMOMETRES SONT LES MEILLEURS POUR MESURER LA TEMPERATURE CORPORELLE?
- MASQUES FACIAUX POUR LA PROTECTION CONTRE LA GRIPPE: 5 OPTIONS
- QUELS MASQUES FAITS MAISON SONT LES PLUS EFFICACES?
- LES PROBIOTIQUES PEUVENT REDUIRE LES SYMPTOMES DE LA DEPRESSION
- CE FILTRE A AIR POURRAIT TUER LE CORONAVIRUS INSTANTANEMENT
- COMMENT PUIS-JE ARRETER DE MANGER DU STRESS?
- COMMENT LE CORONAVIRUS AFFECTE-T-IL LE CORPS?
- COVID-19 POURRAIT AFFECTER DIRECTEMENT LE CŒUR
- UN GUIDE POUR MANGER UNE ALIMENTATION EQUILIBREE
- LES METABOLITES DANS L'URINE OUVRENT LA VOIE A UNE ALIMENTATION PLUS SAINE
- QUE SAVOIR SUR LES MEDICAMENTS QUI COMBATTENT LE COVID-19
- UTILISATION DU SANG CONVALESCENT POUR TRAITER COVID-19: POURQUOI ET COMMENT
- L'HYDROXYCHLOROQUINE PEUT-ELLE TRAITER COVID-19?
- L'HYDROXYCHLOROQUINE REDUIT-ELLE LA MORTALITE DUE AU COVID-19? UN EXPERT APPELLE A LA PRUDENCE
- SUCRE AJOUTE: CE QUE VOUS DEVEZ SAVOIR
- QUEL EST L'IMPACT DE MANGER TROP DE SUCRE?
- COMMENT SE DEBARRASSER D'UNE ECCHYMOSE: REMEDES MAISON
- COMMENT SAVOIR S'IL S'AGIT D'UNE ECCHYMOSE OU D'UN CAILLOT DE SANG
- POURQUOI LE CORONAVIRUS PROVOQUE-T-IL DES CAILLOTS SANGUINS?
- LE RISQUE D'AVC PEUT DEPENDRE DE VOTRE TAILLE ENFANT
- QUE DEVEZ-VOUS FAIRE SI QUELQU'UN A UN AVC?
- TOUT CE QUE VOUS DEVEZ SAVOIR SUR LES AVC
- CE QUE VOUS DEVEZ SAVOIR SUR LA MALADIE DE HUNTINGTON
- DEMENCE: SYMPTOMES, STADES ET TYPES
- UN MEDICAMENT CONTRE L'ASTHME POURRAIT SERVIR A TRAITER LA MALADIE D'ALZHEIMER
- VIH ET SIDA: MYTHES ET REALITES DE LA TRANSMISSION
- IMPACT DE L'INCARCERATION: RISQUE D'INFECTION PAR LE SIDA CHEZ LES HOMMES HOMOSEXUELS NOIRS
- LES LATINO-AMERICAINS SONT PLUS VULNERABLES AU COVID-19, SELON UNE ETUDE AMERICAINE
- REMEDES NATURELS POUR LA CONSTIPATION
- POURQUOI DOIS-JE ESSUYER LE SANG APRES AVOIR FAIT CACA?
- POURQUOI AI-JE UNE DIARRHEE ROUGE? SIX CAUSES
- QU'EST-CE QUI CAUSE UNE DIARRHEE BRULANTE?
- DREPANOCYTOSE: LE CANNABIS PEUT AMELIORER L'HUMEUR LIEE A LA DOULEUR
- CE QU'IL FAUT SAVOIR SUR LA DREPANOCYTOSE
- CE QU'IL FAUT SAVOIR SUR LES TRANSFUSIONS SANGUINES ET LA DREPANOCYTOSE
- TRAIT DREPANOCYTAIRE: CE QUE VOUS DEVEZ SAVOIR
- QUE SAVOIR SUR LES TAUX D'HEMOGLOBINE?
- CE QU'IL FAUT SAVOIR SUR L'ANEMIE
- MOLECULE SANGUINE LIEE AU DECLIN COGNITIF DE LA VIEILLESSE
- CE QU'IL FAUT SAVOIR SUR LA DEMENCE VASCULAIRE
- CE QU'IL FAUT SAVOIR SUR LA DEMENCE DE PARKINSON
- LA NICOTINE ALIMENTAIRE PEUT-ELLE AIDER A COMBATTRE LA MALADIE DE PARKINSON?
- PARKINSON: UN REGIME RICHE EN CALORIES POURRAIT-IL AUGMENTER LA DUREE DE VIE?
- QUELS EXERCICES SONT BONS POUR LA MALADIE DE PARKINSON?
- QUELS EXERCICES SONT BONS POUR LA MALADIE DE PARKINSON?
- CE QUE VOUS DEVEZ SAVOIR SUR LA DIARRHEE
- QUELS ALIMENTS MANGER SI VOUS AVEZ LA DIARRHEE
- CAUSES ET TRAITEMENTS DE LA GRIPPE INTESTINALE
- TOUT SUR L'INTOXICATION ALIMENTAIRE
- TOUT CE QUE VOUS DEVEZ SAVOIR SUR LA GASTRITE
- QUELLES SONT LES CAUSES ET LES SYMPTOMES DE LA GASTRITE CHRONIQUE?
- BRULURES D'ESTOMAC: POURQUOI CELA SE PRODUIT ET QUE FAIRE
- QU'EST-CE QUE LE REFLUX ACIDE?
- QU'EST-CE QUI CAUSE DES DOULEURS A L'ESTOMAC LA NUIT?
- CAUSES DES DOULEURS ABDOMINALES ET DES FRISSONS
- HEMORROÏDES THROMBOSEES: CE QUE VOUS DEVEZ SAVOIR
- QUE SAVOIR SUR LES HEMORROÏDES
- PRESSION RECTALE: CAUSES ET QUAND CONSULTER UN MEDECIN
- QU'EST-CE QUI PEUT PROVOQUER DES DOULEURS ABDOMINALES ET DE LA CONSTIPATION?
- 8 POSES DE YOGA POUR SOULAGER LA CONSTIPATION
- LE BLOCAGE DES RECEPTEURS OPIOÏDES «ATYPIQUES» PEUT AIDER A TRAITER LA DOULEUR CHRONIQUE
- QUELLES SONT LES MEILLEURES SOURCES D'OMEGA-3?
- LE VACCIN COVID-19 EST SUR ET DECLENCHE UNE REPONSE IMMUNITAIRE DANS UN ESSAI HUMAIN
- QU'EST-CE QU'UN VACCIN? TYPES, ETAPES D'APPROBATION
- QUELS SONT LES EFFETS SECONDAIRES POSSIBLES DU VACCIN CONTRE L'HEPATITE B?
- UN REGIME VEGETALIEN PEUT FAVORISER UN VIEILLISSEMENT EN BONNE SANTE
- L'OCYTOCINE, «L'HORMONE DE L'AMOUR», PEUT-ELLE TRAITER LA MALADIE D'ALZHEIMER?
- UN TRAVAIL DE BUREAU PEUT REDUIRE LE RISQUE DE DECLIN COGNITIF
- DES MUTATIONS RARES EN REVELENT PLUS SUR LE COVID-19 ET LE SYSTEME IMMUNITAIRE
- RECHERCHE OPTIMISTE SUR LE COVID-19: PAS UN MAIS DEUX VACCINS SONT PROMETTEURS
- CE QU'IL FAUT SAVOIR SUR LES ACIDES GRAS OMEGA-3
- L'HUILE DE COCO: SAINE OU MALSAINE?
- QUE SAVOIR SUR L'HUILE DE COCO
- AVANTAGES POUR LA SANTE ET RISQUES DU CHOCOLAT
- COMMENT LE CHOCOLAT NOIR POURRAIT AMELIORER LA SANTE ET L'IMMUNITE DU CERVEAU
- COMMENT FONCTIONNE LE SYSTEME IMMUNITAIRE
- DES MUSCLES FORTS PEUVENT SOUTENIR LE SYSTEME IMMUNITAIRE
- UTILISER LE SANG CONVALESCENT POUR TRAITER COVID-19: POURQUOI ET COMMENT
- UNE «INQUIETUDE CROISSANTE» SUR LES DISPARITES LIEES A LA RACE DU COVID-19
- AUGMENTER LES ANTIOXYDANTS CEREBRAUX POURRAIT AMELIORER LES RESULTATS DE LA PSYCHOSE
- DES MEDICAMENTS COMME LE PROZAC POURRAIENT-ILS LUTTER CONTRE L'INTOXICATION ALIMENTAIRE?
- DIABETE DE TYPE 1: L'IA POURRAIT AIDER LES GENS A GERER LEUR ETAT
- LA VITAMINE A PEUT AIDER A TRAITER LA PERTE DE VISION PRECOCE DU DIABETE
- DES NIVEAUX DE LITHIUM PLUS ELEVES DANS L'EAU POTABLE POURRAIENT-ILS AIDER A PREVENIR LE SUICIDE?
- COVID-19: L'IMPACT SUR LA SANTE MENTALE DES PERSONNES DE COULEUR ET DES GROUPES MINORITAIRES
- TOUT CE QUE VOUS DEVEZ SAVOIR SUR LA FRAGILITE DU BLANC
- LE NOUVEAU CORONAVIRUS PEUT SE PROPAGER PLUS FACILEMENT DANS LES MAISONS SURPEUPLEES
- UN TEST DE DIABETE GENETIQUE EFFICACE CHEZ LES PERSONNES D'ORIGINE INDIENNE
- LE MICROBIOME POURRAIT SERVIR DE MEDIATEUR ENTRE LE CHANGEMENT CLIMATIQUE ET LES NOUVELLES MALADIES
- POURQUOI LES PATIENTS EN SOINS INTENSIFS COVID-19 PEUVENT FAIRE FACE A UN RISQUE DE PROBLEMES CARDIAQUES
- LES CHERCHEURS DEVELOPPENT UN PATCH PORTABLE POUR LE MELANOME
- L'ESPOIR CONTRE COVID-19: LA DROGUE REDUIT D'UN TIERS LE NOMBRE DE MORTS ET D'AUTRES DECOUVERTES
- QU'EST-CE QU'UNE REVUE SYSTEMATIQUE EN RECHERCHE?
- QU'EST-CE QU'UNE ETUDE CAS-TEMOINS EN RECHERCHE MEDICALE?
- L'EFFET PLACEBO EST-IL REEL?
- COMMENT FONCTIONNENT LES ESSAIS CLINIQUES ET QUI PEUT PARTICIPER?
- LE MICROBIOME INTESTINAL: COMMENT AFFECTE-T-IL NOTRE SANTE?
- DES BACTERIES NASALES AMICALES PEUVENT PROTEGER CONTRE LA SINUSITE
- LES CHIENS TENTERONT DE SAUVER LEURS PROPRIETAIRES S'ILS LE PEUVENT
- VIOLENCE POLICIERE: REPERCUSSIONS SUR LA SANTE PHYSIQUE ET MENTALE DES NOIRS AMERICAINS
- QUELS SONT LES SYMPTOMES D'UNE FAIBLE TESTOSTERONE?
- LIEN ENTRE LA DEMENCE ET LA PENSEE NEGATIVE REPETITIVE IDENTIFIE
- BRUITS D'ESTOMAC APRES AVOIR MANGE: CAUSES ET TRAITEMENT
- QUELS SONT LES PREMIERS SYMPTOMES DU CANCER CHEZ L'HOMME?
- QUELS SONT LES PREMIERS SYMPTOMES DU CANCER CHEZ L'HOMME?
- TOUS LES HOMMES MEURENT-ILS EGALEMENT?
- TOUT CE QUE VOUS DEVEZ SAVOIR SUR L'ARTHROSE
- CONSEILS DIETETIQUES POUR LA DOULEUR ARTHROSIQUE AU GENOU
- QUEL EST LE MEILLEUR REGIME POUR L'ARTHROSE?
- ARTHROSE: UN NOUVEAU MEDICAMENT D'ESSAI A UN PUISSANT EFFET ANTI-INFLAMMATOIRE
- SEDENTAIRE? SENTEZ-VOUS PLUS HEUREUX AVEC LE SOMMEIL OU L'ACTIVITE LEGERE A LA PLACE
- LE PLASMA CONVALESCENT SEMBLE SUR POUR LE TRAITEMENT DE COVID-19
- COMPARAISON DE 3 APPLICATIONS POUR OPHTALMOSCOPE
- LA DEPRESSION AUGMENTE QUAND VOUS ARRETEZ DE FUMER
- PERTE DE POIDS ET DIABETE
- CANCER DU SEIN: L'HORMONOTHERAPIE PEUT UNIQUEMENT ENDORMIR CERTAINES CELLULES
- LE VACCIN ANTIGRIPPAL PEUT REDUIRE LE RISQUE DE DECES CHEZ LES PERSONNES HYPERTENDUES
- DES NIVEAUX DE LITHIUM PLUS ELEVES DANS L'EAU POTABLE POURRAIENT-ILS AIDER A PREVENIR LE SUICIDE?
- REVES A L'EPOQUE DU CORONAVIRUS: COMMENT ONT-ILS CHANGE ET POURQUOI?
- CAUSES DES REVES VIFS
- CONSEILS POUR MIEUX DORMIR
- CE QU'IL FAUT SAVOIR SUR LE SOMMEIL AVEC DES BOUCHONS D'OREILLE
- AVANTAGES DE LA PASSIFLORE POUR L'ANXIETE ET L'INSOMNIE
- LE CANNABIS PEUT-IL ETRE UN SOMNIFERE?
- COMMENT DORMIR SI VOUS AVEZ MAL AU BAS DU DOS?
- FAIRE BAISSER LA PRESSION ARTERIELLE AVEC LA METHODE DU GUA SHA
- 10 SIGNES ALARMANTS QUI INDIQUENT QUE TON CŒUR NE FONCTIONNE PAS CORRECTEMENT
- LOMBALGIE EXERCICES DE KINE
- HYDROXYCHLOROQUINE: QUAND MEDECINE , POLITIQUE ET INTERETS STRICTEMENT FINANCIERS DES LABORATOIRES S'AFFRONTENT
- REANIMATION CARDIAQUE AVEC DEFIBRILATEUR
- COMMENT UTILISER UN DEFIBRILLATEUR
- LES PROBIOTIQUES PEUVENT STIMULER L'APPRENTISSAGE ET LA MEMOIRE DES PATIENTS ATTEINTS DE LA MALADIE D'ALZHEIMER
- LA BIERE, LA CONSOMMATION DE CHOCOLAT PARMI LES FACTEURS QUI INFLUENCENT LE MICROBIOME INTESTINAL
- LES SCIENTIFIQUES PROPOSENT UN TEST BON MARCHE ET ACCESSIBLE POUR L'EFFICACITE DES MASQUES
- VARIANTE GENETIQUE LIEE A UN RISQUE ACCRU D'AVC CHEZ LES NOIRS
- MYTHES MEDICAUX: LE MYSTERE DU SOMMEIL
- LES CANNABINOÏDES, Y COMPRIS LE CBD, PEUVENT INTERAGIR AVEC LES MEDICAMENTS PRESCRITS
- COMBIEN D'EAU DEVEZ-VOUS BOIRE PAR JOUR?
- LE MIEL PEUT-IL SOULAGER LES SYMPTOMES DE LA TOUX ET DU RHUME?
- L'AIL PEUT-IL PREVENIR OU TRAITER LE RHUME?
- COVID-19: DES RESULTATS PROMETTEURS POUR LE VACCIN RUSSE
- LES ANTICORPS COMBATTENT LE NOUVEAU CORONAVIRUS, MAIS QUE FONT LES CELLULES T?
- COVID-19: COMMENT UN NOUVEAU TEST SANGUIN POURRAIT AIDER A ACCELERER
- QUEL EST LE POIDS MOYEN DES FEMMES?
- UNE ETUDE SUGGERE QUE L'EXERCICE TOT LE MATIN PEUT REDUIRE LE RISQUE DE CANCER
- MYTHES MEDICAUX: REGIMES VEGETARIENS ET VEGETALIENS
- LA LONGUE ET ETRANGE HISTOIRE DES THEORIES DU COMPLOT SUR LE CONTROLE DE LA POPULATION DE BILL GATES
- PFIZER A FALSIFIE LES DONNEES D'ESSAIS SELON LE BRITISH MEDICAL JOURNAL
- LE BRITISH MEDICAL JOURNAL PUBLIE UN RAPPORT ACCABLANT AFFIRMANT QUE PFIZER A FALSIFIE LES DONNEES DE VACCINS DANS LES ESSAIS
- LE BRITISH MEDICAL JOURNAL PUBLIE UN RAPPORT ACCABLANT AFFIRMANT QUE PFIZER A FALSIFIE LES DONNEES DE VACCINS DANS LES ESSAIS
- PFIZER FALSIFIED COVID-19 VACCINE DATA IN TRIALS
- LES REVELATIONS DE MAUVAISES PRATIQUES AIDANT A MENER A BIEN L'ESSAI DU VACCIN COVID-19 DE PFIZER
- LES « VACCINS » DE COVID ONT MAINTENANT UNE EFFICACITE REELLE DE MOINS 73%
- ETUDE QUI A REVELE QUE LES INJECTIONS COVID AUGMENTENT CONSIDERABLEMENT LE RISQUE D'INFECTION
- LA DERNIERE CENSURE DE GOOGLE EN RAISON DE LEUR INVESTISSEMENT DANS LES VACCINS
- BILL GATES ADMET QUE LES VACCINS COVID N'ARRETENT PAS LA TRANSMISSION DE COVID
- BILL GATES ADMET QUE LES VACCINS COVID N'ARRETENT PAS LA TRANSMISSION DE COVID
- LE DR ROBERT MALONE EST «ENERVE PAR LES MENSONGES»
- LE DR ROBERT MALONE EST «ENERVE PAR LES MENSONGES»
- APRES AVOIR REJETE L'IMMUNITE NATURELLE, LE CDC ABANDONNE DESORMAIS TOUT LE CONCEPT D'IMMUNITE COLLECTIVE
- LES MONDIALISTES PREPARENT UN PLAN «PARFAIT» POUR COUVRIR LES DECES DUS AUX VACCINS
- UN DIRIGEANT DE BAYER AFFIRME QUE LES INJECTIONS D'ARNM DE COVID SONT UNE "THERAPIE GENIQUE"
- VACCIDENTS À GOUT: PLUS DE PERSONNES MEURENT DANS DES ACCIDENTS DE LA CIRCULATION
- LE GOUVERNEMENT ITALIEN QUALIFIE LES MANIFESTANTS PACIFIQUES DE TERRORISTES
- PASSE SANITAIRE DÉSACTIVÉ POUR LES FRANÇAIS QUI N'OBTIENNENT PAS LE TROISIÈME VACCIN
- UN BREVET TECHNOLOGIQUE SUGGERE QUE LES SEIGNEURS DE LA TECHNOLOGIE ENVISAGENT DE SURVEILLER NUMERIQUEMENT LES GENS
- BILL GATES ET ANTHONY FAUCI ADMETTENT QUE LES VACCINS CONTRE LE CORONAVIRUS NE FONCTIONNENT PAS COMME ANNONCE
- DES FLACONS DE « PETITE VARIOLE » TROUVES AU LABORATOIRE MERCK DE LA BANLIEUE DE PHILADELPHIE
- UN MEDECIN AFFIRME QUE LES «VACCINS» CONTRE LE COVID BLOQUENT L'IMMUNITE
- SYNDROME DE BOOSTER : UN MEDECIN NATUREL SIFFLE CONTRE LES VACCINS COVID
- LES DONNEES DE L'AGENCE EUROPEENNE DES MEDICAMENTS MONTRENT 1 163 356 REACTIONS INDESIRABLES AUX VACCINS
- LA PROTEINE DE POINTE DANS LES VACCINS PROVOQUE UNE DESINTEGRATION GENETIQUE
- LES CITOYENS FRANÇAIS SURESTIMENT LARGEMENT LE TAUX DE MORTALITE LIE AU COVID-19 EN RAISON DU LAVAGE DE CERVEAU DES MEDIAS
- DES MEDECINS TOMBANT COMME DES MOUCHES DANS DES DECES DECRITS COMME "MORTS DE MANIERE INATTENDUE" ET "MORTS SUBITEMENT"
- L'IRLANDE IMPOSE LE CONFINEMENT ET LE COUVRE-FEU A UNE POPULATION VACCINEE A 93 %
- LA NECROLOGIE DE L'HOMME MET EN GARDE LES « NON-VACCINES » : « NE LE FAITES PAS
- DES PAGES WEB SUPPRIMEES REVELENT QUE BILL GATES LOUE "L'AMITIE" DU GROUPE DU PARTI COMMUNISTE CHINOIS
- PATROUILLE DE POLICE AUTRICHIENNE, AUTOROUTES A LA RECHERCHE DES NON VACCINES
- LA COUR SUPREME DE CALIFORNIE DONNE RAISON AUX VICTIMES DU CANCER DES HERBICIDES ROUNDUP
- DIABOLIQUE : COMMENT L'IDENTIFICATION NUMERIQUE CONTROLERA VOTRE VIE
- PLUS DE 10 000 AUSTRALIENS VEULENT ETRE INDEMNISES POUR LES EFFETS SECONDAIRES DU VACCIN COVID-19
- UNE ETUDE CHOQUANTE DU NEJM REVELE QUE L'EFFICACITE DU VACCIN S'EFFONDRE APRES SEULEMENT DEUX MOIS «DANS TOUS LES GROUPES D'AGE»
- DR STELLA IMMANUEL : COVID EST COMPLETEMENT TRAITABLE ET PERSONNE N'A BESOIN DE MOURIR
- VILLE QUI A ATTEINT UN TAUX DE VACCINATION DE 100 % EN MARS 2021
- CRISES CARDIAQUES CHEZ LES FEMMES JEUNES, EN FORME ET EN BONNE SANTE
- CRISES CARDIAQUES CHEZ LES FEMMES JEUNES, EN FORME ET EN BONNE SANTE
- BILL GATES COFINANCE LE PROJET SUD-COREEN DE « PREPARATION AUX EPIDEMIES » BASE SUR LES TIC
- BILL GATES A ETE SURPRIS EN TRAIN DE VERSER 319 MILLIONS DE DOLLARS AUX MEDIAS POUR « LAVER LE CERVEAU DU PUBLIC »
- 4 FOIS PLUS DE PERSONNES VACCINEES MEURENT QUE DE PERSONNES NON VACCINEES
- CARTEL CRIMINEL DE DROGUES : LA FDA REFUSE DE PUBLIER LES DONNEES DU VACCIN COVID DE PFIZER JUSQU'EN 2076
- LES MEDIAS GRAND PUBLIC ACCUSENT « LE CHANGEMENT CLIMATIQUE, TOUT SAUF LES INJECTIONS
- LES MEDECINS QUI POUSSENT LES VACCINS « TOMBENT COMME DES MOUCHES » APRES S'ETRE FAIT PIQUER PAR LE VIRUS
- TOP 5 DES RAISONS DE NE JAMAIS RECEVOIR DE VACCIN DE RAPPEL COVID
- MERCK POURRAIT-IL DECLENCHER UNE PANDEMIE DE SMALLPOX
- LE GOUVERNEMENT AMERICAIN S'APPRETE A DEPLOYER L'ARME BIOLOGIQUE ANTIVARIOLIQUE
- OUTRE L'AUTRICHE, PLUSIEURS AUTRES PAYS IMPOSENT DESORMAIS DES «VACCINS» CONTRE LE COVID AUX CITOYENS
- UN EXPERT EN CANCER DIT QUE LE ROYAUME-UNI VOIT UN PIC DE "DECES NON LIES A LA COVID", PERSONNE NE VEUT LES RELIER AUX VACCINS
- LE "VACCIN" CONTRE LE COVID EST DANGEREUX POUR LES ENFANTS, PREVIENT UN ANCIEN RESPONSABLE MEDICAL AUSTRALIEN
- DES DIZAINES D'ATHLETES VACCINES S'EFFONDRENT SOUDAINEMENT ET PERSONNE N'EST AUTORISE A SE DEMANDER POURQUOI
- LES MEDIAS HYSTERIQUES SYSTEMES VOMISSENT UNE AUTRE CAMPAGNE « EFFRAYANTE » DE COVID DESESPEREE POUR UN CONTROLE TOTALITAIRE
- LES DONNEES DU VAERS REVELENT UNE MULTIPLICATION PAR 50 DES GROSSESSES EXTRA-UTERINES APRES LES INJECTIONS COVID-19
- LA SCIENCE EST CLAIRE : UNE COUVERTURE « VACCIN » PLUS ELEVEE CONTRE LE COVID EQUIVAUT A UNE SURMORTALITE PLUS ELEVEE
- LA POLIO EST UNE MALADIE D'ORIGINE HUMAINE CAUSEE PAR L'EXPOSITION AUX METAUX LOURDS, PAS UN VIRUS
- L'AUSTRALIE ADMET AVOIR UTILISE L'ARMEE POUR ENVOYER DES GENS DANS DES CAMPS DE COVID
- IL N'Y A AUCUNE PREUVE SCIENTIFIQUE QUE LES VACCINS CONTRE LE COVID-19 ONT SAUVE UNE SEULE VIE
- DES SCIENTIFIQUES ISRAELIENS DOCUMENTENT L'ÉCHEC RAPIDE DES VACCINS CONTRE LE COVID
- NOUVELLE VARIANTE « OMICRON » JUSQU'A PRESENT DETECTEE UNIQUEMENT CHEZ LES « ENTIEREMENT VACCINES »
- LES ALLEMANDS QUI VEULENT MOURIR DOIVENT DESORMAIS SE FAIRE « VACCINER »
- UNE NOUVELLE "VARIANTE" DE COVID TROUVEE EN EUROPE
- LA PANIQUE FABRIQUEE PAR LES MEDIAS DE MASSE A PROPOS DE LA NOUVELLE VARIANTE DE COVID
- NOVAVAX DIT QU'IL AURA UN NOUVEAU "VACCIN" PRET DANS SEULEMENT DEUX SEMAINES POUR LA VARIANTE "OMICRON"
- UN MEILLEUR MEDECIN SUD-AFRICAIN AFFIRME QUE LES SYMPTOMES DE LA VARIANTE OMICRON DU COVID-19 SONT «LEGERS»
- LES VACCINS COVID DOUBLENT LE RISQUE D'INCIDENTS CARDIAQUES, 29 FOIS PLUS DE MORTINAISSANCES
- FAUT-IL AVOIR PEUR DE LA VARIANTE OMICRON ? LES POUSSINS DE LA RESISTANCE NE LE PENSENT PAS
- DRS. BRYAN ARDIS ET PETER MCCULLOUGH PARLENT DE LA MORT D'ATHLETES APRES AVOIR REÇU DES VACCINS COVID
- LA COUR D'APPEL SUSPEND L'ORDONNANCE DE DISCOURS FORCE SUR LE PASTEUR ANTI-CONFINEMENT ARTUR PAWLOWSKI
- « NOUS SOMMES DES RATS DE LABORATOIRE » : LES VICTIMES ISRAELIENNES DU VACCIN VEULENT RECUPERER LEUR VIE
- LA VERITE SUR LA QUERCETINE ET CE DONT LES MEDIAS GRAND PUBLIC NE PARLENT PAS
- LES VACCINS COVID INDUISENT UNE DEFAILLANCE DU SYSTEME IMMUNITAIRE DU « SIDA »
- ISRAËL LES VACCINS ET LES « RAPPELS » S’AVERENT MEDICALEMENT INUTILES
- UN MEDECIN DE PREMIER PLAN AFFIRME QUE LES « VACCINS » CONTRE LE COVID
- UN HOMME DU TEXAS DOTE D'UNE IMMUNITE NATURELLE MEURT APRES AVOIR ETE CONTRAINT DE PRENDRE LE VACCIN
- LES DECES D'ENFANTS AU ROYAUME-UNI AUGMENTENT APRES LE DEPLOIEMENT DU VACCIN COVID-19
- ANALYSTE DE L'INDUSTRIE : "SI VOUS OBTENEZ LE VACCIN PFIZER , VOUS ETES PLUS SUSCEPTIBLE D'AVOIR LE COVID"
- POURSUITE DEPOSEE DEVANT LA HAUTE COUR INDIENNE CONTRE BILL GATES ET D'AUTRES POUR LA MORT DU VACCIN COVID-19
- LE PREMIER LOT DE DOCUMENTS MONTRE PLUS DE 1 200 DECES DUS AU VACCIN AU COURS DES 90 PREMIERS JOURS
- UN DOCUMENT CONFIDENTIEL DE PFIZER FEU EXPOSE LA DISSIMULATION CRIMINELLE DE LA FDA DES DECES PAR VACCIN
- LES « PASSEPORTS VACCINAUX » SOUS-CUTANES A POINTS QUANTIQUES DE BILL GATES SONT PRETS A ETRE INJECTES A DES SUJETS HUMAINS
- DES PREUVES INDIQUENT QUE COVID-19 EST UNE ARME BIOLOGIQUE
- OMICRON POURRAIT-IL ETRE LE REMEDE CONTRE LE COVID ?
- FAUCI DIRIGE « L'ILE SECRETE DES SINGES » POUR MENER DES EXPERIMENTATIONS ANIMALES
- PFIZER ET LE GOUVERNEMENT ONT CACHE DES MILLIERS DE MORTS
- LES « VACCINS » A ARNM AUGMENTENT CONSIDERABLEMENT LES MARQUEURS INFLAMMATOIRES LIES AU SYNDROME CORONARIEN AIGU
- LE JAPON MET EN GARDE CONTRE LES RISQUES POUR LA SANTE CARDIAQUE DES VACCINS COVID
- LES VACCINS CONTRE LE COVID DE PFIZER MONTRE QUE 1 223 DÉCÈS ONT DEJA ETE SIGNALES DEBUT FEVRIER 2021
- IL MONTRE QUE LES VACCINS A ARNM CAUSENT DES LESIONS CARDIAQUES
- BILL GATES A VERSE 319 MILLIONS DE DOLLARS AUX PRINCIPAUX MEDIAS GRAND PUBLIC
- TOP 8 DES REACTIONS INDESIRABLES LES PLUS COURANTES ET GRAVES AUX VACCINS COVID
- DES PERSONNES PROTESTENT CONTRE LES BLOCAGES TYRANNIQUES DU COVID-19 ET LES MANDATS DE VACCINATION
- PLUS DE 100 000 TROUBLES PSYCHIATRIQUES COMME LES HALLUCINATIONS ET LE SUICIDE SIGNALES APRES LA VACCINATION CONTRE LE COVID
- WHATSAPP ET IMESSAGE PARTAGENT LES DONNEES DES UTILISATEURS AVEC LE FBI, UN DOCUMENT DIVULGUE MONTRE
- UN SCIENTIFIQUE RUSSE AFFIRME QUE LA SOUCHE OMICRON « POURRAIT METTRE FIN A LA PANDEMIE DE COVID »
- LA PREUVE QUE LES « VACCINS » COVID CAUSENT LA MALADIE A PRIONS
- LES VACCINES MEURENT CLAIREMENT PLUS RAPIDEMENT QUE LES NON VACCINES, SELON LES DONNEES BRITANNIQUES
- LA MOITIE DE TOUS LES DECES PAR « VACCINS » DE COVID SURVIENNENT DANS LES DEUX PREMIERES SEMAINES
- LE RAPPORT DU DR HOTZE : LE VACCIN COVID EST UN « CHEVAL DE TROIE » POUR QUELQUE CHOSE DE SINISTRE
- DE PLUS EN PLUS DE JEUNES ATHLETES SONT BLESSES OU TUÉS PAR LE VACCIN CONTRE LE COVID
- LES TAUX DE SURMORTALITE AUGMENTENT A MESURE QUE DE PLUS EN PLUS DE PERSONNES SE FONT VACCINER
- AVEC UN TAUX DE VACCINATION DE PRES DE 100% PRES DE 10% DES RESIDENTS MEURENT DES MAISONS DE SOINS INFIRMIERS
- LES ADULTES ANGLAIS VACCINES DE MOINS DE 60 ANS MEURENT DEUX FOIS PLUS VITE QUE LES PERSONNES NON VACCINEES DU MEME AGE
- DES CHERCHEURS CONSIDERENT LE GINSENG COMME MEDICAMENT NATUREL POUR PREVENIR L'OBESITE
- LE PREMIER AMERICAIN A CONTRACTER LA VARIANTE OMICRON COVID A ETE «ENTIEREMENT VACCINE», ADMET FAUCI
- LA PROTEINE DE POINTE DANS LE VIRUS COVID ET LES INJECTIONS AFFAIBLISSENT LE SYSTEME IMMUNITAIRE, PEUVENT ETRE LIEES AU CANCER
- LA SCUTELLAIRE CHINOISE PEUT TUER LES CELLULES CANCEREUSES DU CERVEAU, GRACE A SON COMPOSANT ACTIF BAICALEINE
- UNE FORMULE CHINOISE A BASE DE PLANTES PROTEGE CONTRE LA MALADIE DE PARKINSON
- INBRAIN NEUROELECTRONICS DECRIT LES BIOCIRCUITS CONTROLANT LE CERVEAU A L'AIDE DE GRAPHENE ALIMENTE PAR L'IA
- SOLUTIONS NUTRITIONNELLES CONTRE COVID QUI SOUTIENNENT LA FONCTION IMMUNITAIRE EN PRESENCE DE TOUTES LES VARIANTES
- 20 PREPARATIONS A BASE DE PLANTES POUR VOTRE ARMOIRE A PHARMACIE
- 18 REMÈDES À BASE DE PLANTES QUE TOUT LE MONDE PEUT FAIRE À LA MAISON
- LE RAPPORT DU DR HOTZE : OXYDE DE GRAPHENE TROUVE DANS LES VACCINS COVID
- DR ROBERT MALONE RAPPELLE AUX GENS QU'IL N'EST PAS ANTI-VAXX
- COMMENT GUÉRIR VOTRE INTESTIN NATURELLEMENT
- UNE NOUVELLE ÉTUDE ÉTABLIT UN LIEN ENTRE LA MALADIE DE PARKINSON ET L'ABONDANCE DE PATHOGÈNES OPPORTUNISTES DANS L'INTESTIN
- « 98 % A 99 % DU FLACON DE VACCINATION EST DE L'OXYDE DE GRAPHENE »
- OXYDE DE GRAPHENE UTILISE DANS LES VACCINS CONTRE LES CORONAVIRUS LIES A DES EVENEMENTS INDESIRABLES, VOIRE A LA MORT
- ISRAËL TRAQUE LES TELEPHONES DES CITOYENS POSITIFS POUR LA VARIANTE OMICRON
- URSULA VON DER LEYEN, DIT QU'ELLE ENVISAGE D'IMPOSER DES "VACCINS" CONTRE LE COVID A TOUTE L'EUROPE
- VIETNAM ARRÊTE LES VACCINS PFIZER CONTRE LE COVID APRES L'HOSPITALISATION DE 120 ETUDIANTS
- 14 PASSAGERS SUD-AFRICAINS POSITIFS A L'OMICRON ONT ETE ENTIEREMENT VACCINES
- BIG PHARMA VA RECOLTER DES REVENUS ENORMES AU DETRIMENT DE LA VIE DES GENS
- UN PROGRAMME DE TEST PCR EXPOSÉ COMME UNE FRAUDE SCIENTIFIQUE TOTALE
- ÉTUDE : LES « VACCINS » CONTRE LE COVID N’APPORTENT AUCUN BENEFICE AUX ENFANTS
- EVITER LES PAYS HAUTEMENT VACCINÉS EN RAISON DU NOMBRE ELEVE DE CAS DE COVID
- UN EXPERT EN VACCINS AVERTIT LES NON VACCINES DE NE JAMAIS PRENDRE DE VACCINS COVID
- FAUCI DIT QUE "COMPLETEMENT VACCINE" SIGNIFIERA BIENTOT TROIS INJECTIONS
- DES INFIRMIERES NON VACCINEES LICENCIEES SONT REMPLACEES PAR DES TROUPES DE LA GARDE NATIONALE
- BIOLOGISTE MOLECULAIRE : NOUS POURRIONS POTENTIELLEMENT STERILISER UNE GENERATION ENTIERE AVEC DES VACCINS COVID
- ÉTUDE : MARCHER AU MOINS 45 MINUTES PAR JOUR PEUT AIDER A PREVENIR LE CANCER
- UN TOXICOLOGUE AMERICAIN APPELLE A L'ARRET IMMEDIAT DES INJECTIONS DE COVID EN RAISON DE MULTIPLES PROBLEMES DE SECURITE
- UN RESPONSABLE ISRAELIEN DIT QUE SEPT INJECTIONS POURRAIENT ETRE NECESSAIRES POUR SE PROTEGER DU COVID
- LES PROTEINES DE POINTE DU « VACCIN » DE COVID DETRUISENT LES VOIES DE REPARATION DE L'ADN
- LE MEDECIN-CHEF DE MODERNA ADMET QUE L'ARNM MODIFIE L'ADN
- MASQUES AU GRAPHENE : POURQUOI LES EVITER ET COMMENT LES IDENTIFIER
- LES CAS DE VSIDA INDUITS PAR LA VACCINATION EN AUGMENTATION EN RAISON DE LA VACCINATION DE MASSE CONTRE LE COVID
- SYNDROME D'IMMUNODEFICIENCE ACQUISE PAR LE VACCIN (VAIDS) : « NOUS DEVRIONS ANTICIPER UNE EROSION IMMUNITAIRE PLUS LARGE »
- PERSONNE NE PEUT HONNETEMENT PRETENDRE QUE LE VACCIN PFIZER A ETE PROUVE PAR UN ESSAI CLINIQUE POUR SAUVER DES VIES
- LES VACCINS COVID ONT ETE CONÇUS POUR ECHOUER
- POUVEZ-VOUS VOUS « DESINTOXIQUER » DU VACCIN COVID-19 ? NON
- LA CHIRURGIE DE LA CATARACTE PEUT REDUIRE LE RISQUE DE DEMENCE
- ANTHONY FAUCI, TOUJOURS CORROMPU, EST A LA FDA CE QUE LE DR MORRIS FISHBEIN ETAIT A L'AMA
- POURQUOI LA VACCINATION INTRAMUSCULAIRE COVID-19 DOIT ECHOUER
- DES MEDECINS ET DES SCIENTIFIQUES ECRIVENT A L'AGENCE EUROPEENNE DES MEDICAMENTS POUR AVERTIR
- ISRAËL DIT QUE LES INJECTIONS DE RAPPEL DE COVID SERONT DESORMAIS SANS FIN
- TEMOIGNAGE PARALYSIE FACIALE APRES INJECTION PFIZER
- L'EXPOSITION A LA 5G EST UN «FACTEUR IMPORTANT» DANS LES CAS DE COVID PLUS ELEVES, LES DECES
- AT&T ET VERIZON RETARDENT LE DEPLOIEMENT DE LA 5G POUR DES RAISONS DE SECURITE
- PROFESSEUR ADJOINT DE NEUROLOGIE A LA HARVARD MEDICAL SCHOOL AFFIRME QUE LES BLESSURES GRAVES DU VACCIN COVID
- «ÉMEUTE LYMPHOCYTAIRE»: LES PATHOLOGISTES ENQUETENT SUR LES DECES APRES LA VACCINATION COVID
- AGENT PATHOGÈNE À L'OXYDE DE GRAPHÈNE TROUVÉ SUR LES MASQUES FACIAUX ET LES ÉCOUVILLONS
- LE PROBLEME DE L'EUROPE AVEC LES MASQUES TOXIQUES : « EST-CE QUE VON DER LEYEN SAIT MEME CE QU'ELLE A INHALE ? »
- LE PROBLEME DE L'EUROPE AVEC LES MASQUES TOXIQUES : « EST-CE QUE VON DER LEYEN SAIT MEME CE QU'ELLE A INHALE ? »
- UN DOCUMENTAIRE ACCUSE PFIZER DE PAYER DES "EXPERTS" POUR REPANDRE DES MENSONGES SUR LES VACCINS CONTRE LE COVID
- LES «VACCINS» CONTRE LE COVID EMPECHENT LES RECEVEURS D'ACQUERIR JAMAIS UNE VERITABLE IMMUNITE
- APRES AVOIR ETE ENDOMMAGE PAR LE VACCIN, SI VOUS VOUS PLAIGNEZ DE SYMPTOMES
- LES «VACCINS» CONTRE LE COVID DECLENCHENT DES TROUBLES PSYCHIATRIQUES
- L'ORGANISME DE REGLEMENTATION PHARMACEUTIQUE BRITANNIQUE N'A JAMAIS INSPECTE LES DONNEES DE L'ETUDE SUR LES VACCINS DE PFIZER
- LES RESPONSABLES DU CDC ET DU NIH SE SONT ASSOCIES A ECOHEALTH
- LA PROCHAINE PHASE DE LA PLANDEMIE CONCERNE LES PASSEPORTS NUMERIQUES « VACCINS »
- UNE ETUDE SUR LES «VACCINS» DE LA NEW COLUMBIA UNIVERSITY LAISSE TOMBER UNE BOMBE: LES DECES VAERS SOUS-ESTIMES PAR x 20
- UNE VILLE BRESILIENNE REDUIT DE MOITIE LES HOSPITALISATIONS LIEES AU COVID ET LA MORTALITE GRACE A L'IVERMECTINE
- LES VACCINS COVID-19 ONT TUE PRES DE DEUX FOIS PLUS D'ENFANTS QUE LE VIRUS LUI-MEME
- LE BEBE D'UNE MERE « ENTIEREMENT VACCINEE » DECEDE APRES AVOIR SAIGNE A LA NAISSANCE DE LA BOUCHE ET DU NEZ : RAPPORT DU VAERS
- UN EXPERT EN VACCINATION PREVIENT QUE LES PERSONNES VACCINÉES CONTRE LE COVID SONT LA VERITABLE MENACE POUR LA SANTE PUBLIQUE
- LA PERCEE DE LA PUCE "SKYNET" ANNONCEE QUI ESCLAVERA L'HUMANITE AVEC LES CYBERSEIGNEURS DE L'IA… LA FIN DE L'HUMANITE APPROCHE
- PLUS DE 15 000 MEDECINS ET SCIENTIFIQUES SIGNENT UNE DECLARATION S'OPPOSANT A LA VACCINATION DES ENFANTS CONTRE LE COVID-19
- À TAÏWAN, 79% DE TOUS LES NOUVEAUX CAS DE COVID SURVIENNENT DANS LES « VACCINES »
- LES PROPRIETAIRES DE CHIENS SIGNALENT MOINS DE SYMPTOMES DEPRESSIFS PENDANT LA PANDEMIE
- LES GOUVERNEMENTS APPELLENT A LA REPRESSION DE TELEGRAM
- LE DIRECTEUR DU NIH, FRANCIS COLLINS, A CONSPIRE AVEC FAUCI DANS UN EFFORT DE PROPAGANDE
- LE CDC SIGNALE 8 CAS DE MYOCARDITE CHEZ DE JEUNES ETUDIANTS AYANT REÇU LE VACCIN COVID-19 DE PFIZER
- UN LANCEUR D'ALERTE DIT QUE LES JEUNES AUSTRALIENS ENTIEREMENT VACCINES SONT EN TRAIN DE MOURIR
- EXERCICE ET DIABETE : LE ROLE DES ESPECES REACTIVES DE L'OXYGENE
- MEME UN EXERCICE DE FAIBLE INTENSITE POURRAIT REDUIRE LE RISQUE DE DEMENCE
- COMMENT LE CORPS UTILISE LES GRAISSES POUR COMBATTRE LES INFECTIONS
- LANCET DÉTRUIT LE FAUX RECIT DES VACCINS CONTRE LE COVID, REVELE QUE LES VACCINES PERPÉTUENT LA PANDEMIE
- DR. CHARLES LIEBER, SCIENTIFIQUE DE HARVARD, NANOFILS, DOD, CCP, WUHAN, COVID, 5G, NANOTUBES DE CARBONE
- LA PILULE COVID DE MERCK POURRAIT PRESENTER DES RISQUES POUR LES FEMMES ENCEINTES
- L'IMMUNITE NATURELLE CONTRIBUE PROBABLEMENT A LA BAISSE DU TAUX D'HOSPITALISATION
- PFIZER RACHETE UNE SOCIETE PHARMACEUTIQUE QUI FABRIQUE DES MEDICAMENTS POUR LE CŒUR
- LES DOCUMENTS DE LA FOIA REVELENT QUE LE VACCIN EXPERIMENTAL DE PFIZER A PROVOQUE UNE AVALANCHE DE FAUSSES COUCHES
- LA SUISSE VOTERA CONTRE LES POLITIQUES OBLIGATOIRES DE VACCINATION CONTRE LE COVID
- LA SUISSE ORGANISERA UN REFERENDUM SUR L'INTERDICTION DE L'INTRODUCTION DES VACCINATIONS OBLIGATOIRES
- BIG PHARMA GAGNE DE L'ARGENT EN CIBLANT D'ENORMES POPULATIONS DE PATIENTS AVEC DES INTERVENTIONS MEDICALES SOUVENT INUTILES
- DES PERSONNALITES DE LA SANTE PUBLIQUE ACCUSEES DE GÉNOCIDE DANS UNE PLAINTE HISTORIQUE ENVOYEE A LA COUR PENALE INTERNATIONALE
- LE PORT DU MASQUE PEUT ET VA CAUSER L'HYPOXIE ET L'HYPOXEMIE
- 20 CONSEILS POUR UN MEILLEUR SOMMEIL
- TROIS FOOTBALLEURS PROFESSIONNELS SONT MORTS D'UNE CRISE CARDIAQUE EN CINQ JOURS
- LE REDACTEUR EN CHEF DU NEW YORK TIMES, AGE DE 49 ANS, DECEDE D'UNE CRISE CARDIAQUE
- ISRAËL INTERROMPT LE DEPLOIEMENT DU 4E VACCIN COVID ET OPTE POUR UN ESSAI A L'HOPITAL POUR VERIFIER L'EFFICACITE ET LA SECURITE
- UNE ENQUETE EST LANCEE APRES LA MORT D'UNE FILLETTE DE TROIS ANS D'UNE CRISE CARDIAQUE
- LES IMPLANTS DE MICROPUCE QUI SUIVENT VOTRE STATUT VACCINAL SONT DESORMAIS UTILISES EN SUEDE
- L'AUTRICHE EMBAUCHE DES TUEURS A GAGES POUR "TRAQUER LES REFUS DE VACCINS"
- LA LACTOFERRINE, COMBINAISON DE DIPHENHYDRAMINE INHIBE LA REPLICATION DE COVID DE 99%
- UNE ENQUETE CHOQUANTE SUR L'HUILE D'AVOCAT REVELE QUE PRESQUE TOUS SONT FALSIFIES AVEC DE L'HUILE DE SOJA BON MARCHE
- NEW YORK ANNONCE DES EQUIPES DE VACCINATION PORTE-A-PORTE
- LE CO-CONSPIRATEUR DE WUHAN, CHARLES LIEBER, RECONNU COUPABLE DE NOMBREUX CRIMES IMPLIQUANT WUHAN, LA NANOTECHNOLOGIE ET LE PCC
- NOMBRE «ECRASANT» DE CRISES CARDIAQUES ET DE CAILLOTS SANGUINS SURVENANT CHEZ LES PERSONNES ENTIEREMENT VACCINEES
- LA CIA ET LE CCP DEVOILENT UNE « INITIATIVE D'IDENTIFICATION DES VACCINS » QUI IMPLIQUERA LE SUIVI PAR PUCE ELECTRONIQUE
- UN REDACTEUR EN CHEF DU NEW YORK TIMES DE 49 ANS DECEDE UN JOUR SEULEMENT APRES AVOIR REÇU UNE INJECTION DE RAPPEL DE MODERNA
- DES MASQUES VOLONTAIREMENT IMPOSES AUX ENFANTS POUR LES ABRUTIR EN PRIVANT LEUR CERVEAU D'OXYGENE
- LE RADIOLOGUE SIGNALE UNE AUGMENTATION DE 360 FOIS DES ADENOPATHIES APRES LES VACCINATIONS CONTRE LE COVID
- LOI DE NEW YORK MENACE LES DROITS FONDAMENTAUX DES CITOYENS AVEC DES VACCINATIONS FORCEES
- LA NOUVELLE-ZELANDE PAYE DES MEDECINS POUR EUTHANASIER LES PATIENTS ATTEINTS DE COVID-19
- LE DECOMPTE DES DECES SUSPECTS DE COVID EN ITALIE A ETE CORRIGE DE 132 161 A 3 783…
- PAS UN SEUL ESSAI CLINIQUE POUR LES VACCINS CONTRE LE COVID-19 N'A ETUDIE LA TRANSMISSION
- COMMENT LE CDC, LA FDA ET LES MEDIAS ONT TISSE UNE TOILE DE MENSONGES SUR L'IVERMECTINE
- LE DR ROBERT MALONE DECLARE QUE LE GOUVERNEMENT FEDERAL EST « SANS LOI » ET « VIOLE ACTIVEMENT LE CODE DE NUREMBERG »
- L'HYSTERIE PLANDEMIQUE DE GAUCHE POUSSE LES VERMONTOIS ASYMPTOMATIQUES A INONDER LES HOPITAUX
- LA SCIENCE REVELE COMMENT LA VIANDE ROUGE NUIT AU CŒUR
- MYOCARDITE
- QUELS SONT LES SYMPTOMES D'UN CAILLOT SANGUIN?
- TRAITEMENT ET GESTION A DOMICILE DES CAILLOTS SANGUINS
- QUE SAVOIR SUR L'EMBOLIE PULMONAIRE ?
- CE QU'IL FAUT SAVOIR SUR LE CONTROLE DES NAISSANCES ET LES CAILLOTS SANGUINS
- LA NOUVELLE-ZELANDE PAIE DESORMAIS 1 000 $ AUX MEDECINS DE L'EUTHANASIE POUR ASSASSINER DES PATIENTS ATTEINTS DE COVID
- COMBINER LE MIEL AVEC DU CUMIN NOIR AIDE LES PATIENTS COVID: RECHERCHE
- LE CAUCHEMAR DE LA VACCINATION DE MASSE EN ISRAËL S'AGGRAVE
- LE CONSEIL MEDICAL DU MINNESOTA HARCELE UN MEDECIN POUR AVOIR PRESCRIT DE L'IVERMECTINE
- LE GOP EST REMPLI DE POLITICIENS REPUBLICAINS CORROMPUS QUI NE SONT PAS MEILLEURS QUE LES DEMOCRATES
- DOCTEUR MALONE INTERVIEWE PAR JOE ROGAN
- LA ROUMANIE APPROUVE UN PROJET DE LOI SOUTENU PAR LES ÉTATS-UNIS INTERDISANT HUAWEI DE SON RESEAU 5G
- DES PERSONNES VACCINEES MEURENT D'ATTAQUES AUTO-IMMUNES CONTRE LEURS PROPRES ORGANES
- UNE COMPAGNIE D'ASSURANCE-VIE AFFIRME QUE LES DEMANDES DE DECES ONT AUGMENTE DE 40% APRES LES VACCINS CONTRE LE COVID
- LES DECES DES PILOTES AMERICAINS AUGMENTENT DE 1750 % DEPUIS LE DEPLOIEMENT DU VACCIN CONTRE LE COVID
- DES TAUX DE VACCINATION PLUS ELEVES SE TRADUISENT PAR UN NOMBRE PLUS ELEVE DE CAS DE COVID
- LE CDC ADMET QUE LES TESTS PCR SONT UNE FRAUDE
- 92% DE LA COMMUNAUTE LGBTQ A REÇU AU MOINS UN VACCIN COVID
- L'ITALIE REND LES VACCINS COVID-19 OBLIGATOIRES POUR TOUTES LES PERSONNES AGEES DE 50 ANS ET PLUS
- OMICRON A-T-IL ETE CONÇU PAR WHITE HATS COMME UN ANTIDOTE A PROPAGATION AUTOMATIQUE
- COMMENT BAISSER SA TENSION ARTERIELLE
- AU DANEMARK, CAR LES HOSPITALISATIONS « OMICRON » SE PRODUISENT PRINCIPALEMENT CHEZ LES « TOTALEMENT VACCINES »
- QUAND LES PUCES DE SUIVI IMPLANTABLES N'ETAIENT QU'UNE THEORIE DU COMPLOT
- 5G ET OXYDE DE GRAPHENE
- LES ALIMENTS OGM SERONT DESORMAIS ETIQUETES « BIO-INGENIERIE »
- LES MICROPUCES COVID ARRIVENT "QUE CELA NOUS PLAISE OU NON", PREVIENT LE DEVELOPPEUR
- UNE MALADIE SE PROPAGE CHEZ LES JEUNES ADULTES AU CANADA, PROVOQUANT UNE DESTRUCTION COGNITIVE RAPIDE
- LA COUR D'APPEL DU 5E CIRCUIT REMET EGALEMENT EN QUESTION LA VALIDITE DE LA PANDEMIE ET DES RESTRICTIONS GOUVERNEMENTALES
- L'AUSTRALIE ADMET MAINTENANT QUE LES VACCINS CONTRE LE COVID NUISENT AUX GENS
- NOUS ASSISTONS MAINTENANT AUX PREMIERS SIGNES DE LA REDOUTABLE APOCALYPSE DES ZOMBIES VACCINAUX
- UN CAILLOT DE SANG LORSQUE LE SANG LIQUIDE SE TRANSFORME EN UNE MASSE GELATINEUSE SEMI-SOLIDE A L'INTERIEUR DE VOTRE CORPS
- WHOOPI GOLDBERG « CHOQUE » D’AVOIR ATTRAPE COVID MALGRE LE TRIPLE VACCIN
- TWITTER COMPLICE DU GENOCIDE
- L'INVENTEUR DE L'ARNM, LE DR MALONE, DECRIT LA GUERRE MÉDIATIQUE COMPLÈTE COMME LE COMPLEXE COVIDIAN
- QU'EST-CE QUE L'ARNM? VOICI UN COURS ACCELERE SUR CE QU'IL FAIT
- LES CAMPS DE CONCENTRATION DE COVID ACTIVÉS EN AMERIQUE
- GRAPHENE ET 5G
- LES EFFETS DU GRAPHENE SUR LES POUMONS
- QUEL EST L'IMPACT NEGATIF DU GRAPHENE SUR L'ENVIRONNEMENT ?
- COMMENT SUPPRIMER L'OXYDE DE GRAPHENE DU CORPS
- OXYDE DE GRAPHÈNE DANS LES VACCINS, LES MASQUES ET LES ÉCOUVILLONS
- DARPA A REJETE LE GAIN DE FINANCEMENT DE LA RECHERCHE FONCTIONNELLE QUI A CONDUIT AU COVID-19
- LES FEMMES D'AUJOURD'HUI SOUTIENNENT GENERALEMENT LA CENSURE ET LE TOTALITARISME
- LES DECES D'ADOLESCENTS DE SEXE MASCULIN MONTENT EN FLECHE DE 53% APRES UNE VACCINATION DE MASSE CONTRE LE COVID
- LES PROTEINES DE POINTE DU VACCIN COVID-19 SE DETACHENT, PROVOQUANT DES CRISES CARDIAQUES
- BREGGIN ET MCCULLOUGH AVERTISSENT QUE LES VACCINS SONT PLUS DANGEREUX QUE LE COVID-19 – BRIGHTEON.TV
- LES PROGRAMMES DE VACCINATION DE MASSE CONTRE LE COVID-19 VIOLENT LES PRINCIPES DE BIOETHIQUE
- COMMENT RETROUVER VOTRE SENS DU GOUT ET DE L'ODORAT APRES COVID-19
- COMMENT RETROUVER LE GOUT ET L'ODEUR
- COMMENT RETROUVER VOTRE ODEUR ET VOTRE GOÛT
- CINQ FAÇONS DE REHABILITER VOTRE GOUT ET VOTRE ODORAT TOUT EN VOUS REMETTANT DE COVID-19
- PERTE DE GOUT ET D'ODEUR : CAUSES, DIAGNOSTIC ET OPTIONS DE TRAITEMENT NATUREL
- COVID-19 A-T-IL PRIS VOTRE GOUT ET VOTRE ODEUR ? VOICI QUAND ILS PEUVENT REVENIR
- PRESQUE PERSONNE NE FAIT CONFIANCE AUX AUTORITES SANITAIRES AMERICAINES EN CE QUI CONCERNE LES INFORMATIONS SUR COVID
- LA POLICE NAZIE SS-COVID FAIT FACE A UNE REACTION JUSTIFIEE
- APPLE DIT AUX TRAVAILLEURS QU'ILS DOIVENT PRENDRE DES RAPPELS DE VACCIN COVID-19, MEME SI CELA LES TUE
- LES SCEPTIQUES DE COVID ETIQUETES PSYCHOPATHES
- SI LES HOPITAUX AVAIENT UTILISE LE PROTOCOLE ZELENKO AVEC DE LA VITAMINE C ET DE LA VITAMINE D PAR VOIE INTRAVEINEUSE
- 10 CONSEILS POUR SE DEBARRASSER D'UN NEZ BOUCHE
- L'IVERMECTINE INTRODUITE DANS UNE BARRE DE CHOCOLAT SAUVE LA VIE D'UN PATIENT BRITANNIQUE COVID
- DR LEE MERRITT: LE PORT DU MASQUE N'A JAMAIS ETE POUR CONTROLER LE VIRUS
- LE GOUVERNEMENT AMERICAIN SURPRIS EN TRAIN DE CIBLER DES ÉTATS « ROUGES » AVEC DES LOTS PLUS MEURTRIERS DE VACCINS COVID
- UNE FEMME QUI EST ENTREE EN CONTACT AVEC UN SINGE DE LABORATOIRE ECHAPPE MONTRANT DES SIGNES POTENTIELS D'INFECTION
- LE CDC A-T-IL MIS EN SCENE LES « SINGES EN FUITE » COMME COUVERTURE POUR LA SORTIE DE LA PROCHAINE ARME BIOLOGIQUE ?
- LE GOUVERNEMENT DE L'ALBERTA SUPPRIME LES DONNEES
- LES DEMOCRATES TUENT LE PROJET DE LOI DE VIRGINIE QUI AURAIT PERMIS A L'IVERMECTINE D'ETRE PRESCRITE POUR LE COVID
- UN MEDAILLE D'OR OLYMPIQUE DECEDE DE "COVID" ALORS QU'IL ETAIT COMPLETEMENT VACCINE
- LES VACCINS A ARNM PROVOQUENT UNE « TOXICITE SEMBLABLE AUX RADIATIONS » ET SONT CONÇUS POUR EMPOIPOISONNER LES PERSONNES
- TOM RENZ ET EMERALD ROBINSON PARLENT DE LA CORRUPTION DES MEDIAS
- PFIZER INTERVIENT POUR CONTROLER LA FDA ET FACILITER LES SUPPRESSIONS RADICALES DE LA DIVULGATION ORDONNEE PAR LE TRIBUNAL
- 9 CONSEILS POUR DORMIR AVEC LE NEZ BOUCHE
- 9 CONSEILS POUR DORMIR AVEC LE NEZ BOUCHE
- TOP 7 DES HUILES ESSENTIELLES POUR LA CONGESTION DES SINUS
- QUELS REMEDES MAISON PEUVENT AIDER AVEC UN NEZ QUI COULE?
- COMMENT SAVOIR SI J'AI UN RHUME OU UNE SINUSITE ?
- LES DOMMAGES NERVEUX DES VACCINS PEUVENT-ILS ETRE INVERSÉS
- QU'EST-CE QU'UN REMEDE MAISON CONTRE LE RONFLEMENT ?
- LES DONNEES ECOSSAISES MONTRENT QUE LE TAUX DE CAS DE COVID EST LE PLUS ELEVE PARMI LES VACCINES COMPLETS
- PREPARER L'HUMANITE POUR L'ÉCONOMIE D'ABONDANCE QUI RENAITRA DES CENDRES DE LA RARETE ARTIFICIELLE
- UN CAMIONNEUR CANADIEN AFFIRME QUE LES CHAUFFEURS SONT SUIVIS ELECTRONIQUEMENT
- LE LAISSEZ-PASSER VACCINAL DE LA FRANCE TRANSFORME LES NON-VACCINS EN CITOYENS DE SECONDE CLASSE
- LES LANCEURS D'ALERTE DU GOUVERNEMENT METTENT EN GARDE CONTRE L'AUGMENTATION DU CANCER DEPUIS L'INTRODUCTION DES VACCINS COVID
- UN MEDECIN UTILISE DES APPLICATIONS BLUETOOTH POUR DETECTER LES SIGNAUX CHEZ LES PERSONNES «VACCINEES»
- LES NOUVELLES DONNEES D'ASSURANCE-VIE MONTRENT UNE AUGMENTATION DE PLUS DE 258 % DES VERSEMENTS DE PRESTATIONS APRES LE VACCIN
- UNE ANALYSE ALLEMANDE ETONNANTE REVELE QUE LES TAUX DE MORTALITE LIES AU VACCIN COVID-19 SONT BEAUCOUP PLUS ELEVES
- UN POLITICIEN CROATE COMPARE LA VACCINATION OBLIGATOIRE CONTRE LE COVID A LA «PEINE DE MORT»
- UNE MOLECULE TROUVEE DANS LE BROCOLI POURRAIT-ELLE AIDER LE CERVEAU A RÉPARER LES DOMMAGES CAUSES PAR LES PROTEINES DE POINTE ?
- UN GROUPE INTERNATIONAL DE SCIENTIFIQUES TENTE D'ARRETER L'EXPERIENCE DE GRADATION DU SOLEIL DE BILL GATE
- PAS SEULEMENT LES HUMAINS : LES SCIENTIFIQUES DISENT QUE LE RAYONNEMENT 5G TUE LES ANIMAUX ET LA FAUNE
- LES CONFINEMENT A REDUIT LA MORTALITE PAR COVID DE SEULEMENT 0,2% AU MIEUX
- RECHERCHE ISRAELIENNE : LES VACCINS N'EMPECHENT PAS LE COVID-19 GRAVE, MAIS LA VITAMINE D OUI
- LES HOPITAUX GONFLENT INTENTIONNELLEMENT LES CAS DE COVID
- ANTIOXYDANT, ANTI-INFLAMMATOIRE ET BIEN PLUS : LES BIENFAITS DE LA CANNELLE SUR LA SANTE
- UN PATHOLOGISTE DE L'IDAHO DIT QUE LES DONNEES MONTRENT QUE "LES CANCERS DECOLLENT COMME UNE TRAINEE DE POUDRE"
- 12 PAYS EUROPEENS ANNULENT LES RESTRICTIONS COVID, ISRAËL SUPPRIME LE « LAISSEZ-PASSER VERT »
- LES 5 VACCINS LES PLUS TOXIQUES JAMAIS INVENTES ET COMMENT ILS MUTILENT ET TUENT LES HUMAINS
- LES PERSONNES ENTIEREMENT VACCINEES REPRESENTENT LA MAJORITE DES CAS DE COVID
- UN COMPOSE DE CHAMPIGNONS MAGIQUES AGIT COMME PAR MAGIE SUR LES SYMPTOMES DE LA DEPRESSION
- LE DOD ET LE NIH ONT ETE SURPRIS EN TRAIN DE MODIFIER DES DONNEES
- LE CHEF DE LA POLICE D'OTTAWA MENACE D'ARRESTER DES CITOYENS QUI DONNENT DE LA NOURRITURE
- LES «VACCINS» COVID PROVOQUENT DES MICRO-CAILLOTS SANGUINS CHEZ DES MILLIONS DE PERSONNES… ET IL N'Y A PAS DE SOLUTION MEDICALE
- LE DIRECTEUR DE L'INSTITUT DOHERTY REJOINT UN NOMBRE CROISSANT D'EXPERTS QUI DISENT NON AUX BOOSTERS
- LA COUR SUPREME DE LA REPUBLIQUE TCHEQUE : LES EXIGENCES DE VACCINATION FIXEES PAR LE GOUVERNEMENT NE SONT PAS VALIDES
- UN DENONCIATEUR DU GOUVERNEMENT ASSASSINE A MIS EN GARDE EN 1995 CONTRE LE DEPEUPLEMENT MONDIAL
- COMMENT AMELIORER LA CIRCULATION DE VOTRE SANG
- J&J ESSAIE DE SE SORTIR DE L'OBLIGATION DE PAYER 3,5 MILLIARDS DE DOLLARS AUX VICTIMES
- CE QU'IL FAUT SAVOIR SUR LA MAUVAISE CIRCULATION
- VITAMINES ET SUPPLEMENTS POUR AUGMENTER LE FLUX SANGUIN
- TOUT CE QUE VOUS DEVEZ SAVOIR SUR L'ŒDEME
- DES POINTS DE CONTROLE ROUTIERS POUR LA CONFORMITE AU «VACCIN» COVID SE DEPLOIENT EN AUTRICHE
- COMMENT AMELIORER NATURELLEMENT LA CIRCULATION DU SANG
- 10 SUPER ALIMENTS CONTRIBUANT A AMELIORER LA CIRCULATION SANGUINE
- DEBARRASSEZ-VOUS RAPIDEMENT DU MAL DE GORGE AVEC CES REMEDES MAISON
- QUERCETINE : UN FLAVONOÏDE QUI COMBAT LE COVID COMME L'HYDROXYCHLOROQUINE
- DES CHERCHEURS ISRAELIENS DISENT QUE LES ALGUES POURRAIENT ARRETER LA PROPAGATION DU "COVID"
- LES BASES DE LA SURVIE : LE TEST UNIVERSEL DE COMESTIBILITE EN 9 ETAPES
- DES CHERCHEURS CONSIDERENT LE GINSENG COMME UN MEDICAMENT NATUREL POUR PREVENIR L'OBESITE
- GUERISON NATURELLE : 12 REMEDES MAISON CONTRE LE RHUME ET LA GRIPPE
- ANTIOXYDANT, ANTI-INFLAMMATOIRE ET BIEN PLUS : LES BIENFAITS DE LA CANNELLE SUR LA SANTE
- CE CHAMPIGNON MEDICINAL COMESTIBLE DE CHINE PEUT ABAISSER NATURELLEMENT LA GLYCEMIE ET LES TAUX DE LIPIDES SANGUINS
- L'ACUPUNCTURE PEUT-ELLE AIDER A INVERSER LA RESISTANCE A L'INSULINE ?
- 6 RAISONS DE MANGER PLUS DE CHAMPIGNONS REISHI
- ENCENS : L'UN DES MEDICAMENTS LES PLUS PUISSANTS DE MERE NATURE
- 4 RAISONS DE PASSER AU MIEL, UN EDULCORANT NATUREL AUX BIENFAITS ETONNANTS
- L'ANCIEN PROPRIETAIRE DE L'UFC, DANA WHITE, PROUVE QUE LE RECIT DES MEDIAS SUR LES TRAITEMENTS COVID EST UN MENSONGE ABSOLU
- L'EXERCICE POURRAIT ETRE UNE OPTION DE TRAITEMENT « PLUS SURE ET PLUS RAPIDE » POUR L'ANXIETE
- L'AUSTRALIE-OCCIDENTALE INTERDIT AUX PERSONNES NON VACCINEES DE RENDRE VISITE A LEURS PROPRES ENFANTS A L'HOPITAL
- UNE ADOLESCENTE DECEDE QUELQUES HEURES APRES AVOIR REÇU LE DEUXIEME VACCIN PFIZER COVID
- LE MEDECIN QUI A DECOUVERT L'OMICRON : ON M'A DEMANDE DE NE PAS RÉVÉLER QU'IL EST DOUX
- LA SUEDE MET FIN A UN PROGRAMME MASSIF DE TESTS COVID – MEME SUR LES CAS SYMPTOMATIQUES
- LA CHINE A LANCE UNE AUTRE ARME BIOLOGIQUE PENDANT LES JEUX OLYMPIQUES
- LE PRINCIPAL PROPRIETAIRE DE SPOTIFY EST EGALEMENT LE PRINCIPAL PROPRIETAIRE DE MODERNA
- LES DONNEES DU CDC SIGNALENT UNE CATASTROPHE VACCINALE
- LES MEDIAS POUSSENT LE RECIT DE LA "VARIANTE DU VIH" COMME COUVERTURE DE L'EFFONDREMENT DU SYSTEME IMMUNITAIRE
- LES "VACCINS" COVID CAUSENT LE SIDA : LA PREUVE
- LES PIRES DIFFUSEURS DE DESINFORMATION COVID SUR LA PLANETE
- CONFIRMÉ : LES FLACONS DE "VACCINS" COVID CONTIENNENT DEFINITIVEMENT DE L'OXYDE DE GRAPHENE
- LE ZINC PEUT AIDER DANS LA LUTTE CONTRE LE COVID-19 - MAIS SEULEMENT SI VOUS L'ASSOCIEZ A UN IONOPHORE DE ZINC
- VOUS POUVEZ VOUS DESINTOXIQUER DES PROTEINES DE POINTE DU "VACCIN" COVID : VOICI COMMENT
- UN JOURNALISTE D'INVESTIGATION SE FAIT AXER PAR FORBES POUR AVOIR PUBLIE LES REVENUS ANNUELS DU DR ANTHONY FAUCI
- PARTOUT DANS LE MONDE, LES PERSONNES VACCINEES PRESENTENT DES SYMPTOMES SEMBLABLES AU SIDA
- RAPPORT: 4 DECES PAR COVID SUR 5 EN AUSTRALIE CONCERNENT DES PERSONNES VACCINÉES
- MORTALITE DUE AUX VACCINS : LES DECES ENTIEREMENT VACCINES ET TRIPLEMENT VACCINES MONTENT EN FLECHE
- L'AVOCAT THOMAS RENZ DIT QUE DES POURSUITES SONT A VENIR POUR LES CERVEAUX PLANDEMIQUES COVID
- UNE ETUDE EXPLOSIVE CONFIRME LE LIEN ENTRE L'EXPOSITION SANS FIL 5G ET LA MALADIE COVID
- LE RESEAU CRIMINEL COVID MENE AUX PORTES DE L'ENFER
- LA DECOUVERTE DE MATERIEL GENETIQUE LIE AU COVID CONFIRME LES ORIGINES EN LABORATOIRE DU SRAS-COV-2
- LE STEAUA BUCAREST, ANNONCE L'INTERDICTION DES JOUEURS VACCINÉS
- GAËL MONFILS BLAME LA PIQURE DE RAPPEL POUR SON PROBLEME DE SANTE AYANT ENTRAINE SON RETRAIT DU TOURNOI
- BILL GATES DEVELOPPE UN VACCIN SANS AIGUILLE QUI SE PROPAGE COMME UN VIRUS AUX PERSONNES NON VACCINEES
- MEDECIN SUD-AFRICAIN : COVID SEVERE UNE REACTION ALLERGIQUE AUX NANOPARTICULES DE SPIKE PROTEIN
- LES CAS DE COVID-19 ET LES HOSPITALISATIONS BONDISSENT PARMI LES VACCINES: DONNEES DU CDC
- LES PUBLICITES DE PFIZER AVERTISSENT LE MONDE DES PROBLEMES CARDIAQUES GRAVES
- LA PLANDEMIE IMPLOSE ET LES RATS QUI ONT COMMIS DES CRIMES CONTRE L'HUMANITE PANIQUENT
- LES VRAIS AGRESSEURS QUI ATTAQUENT L'HUMANITE SONT LES POUSSEURS DE VACCINS
- L'ETUDE JAMA MONTRE QUE L'IVERMECTINE EST EXTREMEMENT EFFICACE CONTRE LE COVID; LES VACCINS PAS TELLEMENT
- LES PERSONNES ENTIEREMENT VACCINEES PERDENT DU GRAPHÈNE ET INFECTENT LES PERSONNES NON VACCINEES
- ALLEGATIONS D'UNE NOUVELLE VARIANTE PLUS MORTELLE DU VIH
- DES SCIENTIFIQUES DECOUVRENT UNE SEQUENCE D'ADN DANS LE SRAS-COV-2 QUI A ETE BREVETEE PAR MODERNA TROIS ANS
- LE PENTAGONE DIRIGEAIT DES LABORATOIRES D'ARMES BIOLOGIQUES DANS 25 PAYS
- MALADIES INTENSIFIEES, AGGRAVEES ET EXACERBEES PAR LES «VACCINS» COVID
- PFIZER DOC ANALYSE DE NOMBREUX EFFETS INDESIRABLES GRAVES APRES L'INOCULATION
- LE CONTENU DU VACCIN COVID DE PFIZER PENETRE DANS LE FOIE, ALTERE LES CHROMOSOMES HUMAINS ET REECRIT L'ADN
- UN DOCUMENT PFIZER TOP SECRET MONTRE QUE LE VACCIN COVID-19 EST BEAUCOUP PLUS DANGEREUX QUE LE MONDE NE LE SAIT
- C'EST OFFICIEL : MODERNA A CREE LE COVID-19 POUR SOUTIRER DES MILLIARDS AUX VENTES DE "VACCINS"
- FAUCI ET LE CDC ONT MENTI : LES « VACCINS » A ARNM SE CONVERTISSENT EN ADN, ALTERANT LE GENOME DU CORPS HUMAIN
- LES INJECTIONS DE PROTEINES DE POINTE D'ARNM SUPPRIMENT LA REPARATION DE L'ADN
- GOOGLE TECH PEUT LIRE VOTRE LANGAGE CORPOREL - SANS CAMERAS
- DES DOCUMENTS REVELENT QUE LE GOUVERNEMENT FEDERAL A PAYE DES MEDIAS POUR FAIRE L'ELOGE DES VACCINS COVID
- UN DOCUMENT DE PFIZER ADMET QUE LES «VACCINS» COVID PROVOQUENT DE GRAVES EFFETS INDESIRABLES
- VACCINES ET BOOSTES REPRESENTENT LA GRANDE MAJORITE DES CAS DE COVID-19
- L'AUTRICHE SUSPEND LE MANDAT DU VACCIN COVID APRES L'ECHEC DES EFFORTS DE COERCITION
- 3 FEMMES AUSTRALIENNES EPROUVENT DE GRAVES RÉACTIONS APRES AVOIR ETE VACCINEES PAR NOVAVAX COVID
- DES INDIVIDUS ENTIEREMENT VACCINES AU ROYAUME-UNI ET EN NOUVELLE-ZELANDE DEVELOPPENT LE SIDA
- LA RUSSIE DIT QUE L'UKRAINE EST JONCHEE DE LABORATOIRES D'ARMES BIOLOGIQUES FINANCES PAR LES ÉTATS-UNIS
- LES TROUBLES DE L'ALIMENTATION LIES AU SOMMEIL
- FAUCI, WALENSKY, TRUMP ET COLLINS ONT TOUS MENTI SUR LES «VACCINS» COVID
- UN DOCUMENT PFIZER TOP SECRET DIVULGUE MONTRE QUE LE VACCIN COVID-19 EST BEAUCOUP PLUS DANGEREUX
- L'AVOCAT PRESENTE AU CONGRES DES PREUVES QUE LES VACCINS COVID-19 SONT L'UNE DES PLUS GRANDES FRAUDES DE L'HISTOIRE
- GOUVERNEMENT AMERICAIN NIE TOUTE RECHERCHE BIOLOGIQUE EN UKRAINE
- L'UNE DES PLUS GRANDES COMPAGNIES D'ASSURANCE MALADIE D'ALLEMAGNE VIENT DE LICENCIER SON PDG POUR AVOIR DIT LA VERITE
- UN ANCIEN CONSEILLER DE BLACKROCK A DECLARE QUE PFIZER ETAIT DE CONNIVENCE AVEC LA FDA
- LES ARTICLES SCIENTIFIQUES SONT DESORMAIS SOUMIS A UNE CENSURE EXTREME
- N ANALYSTE DE WALL STREET AFFIRME QUE LES «VACCINS» COVID SONT LA «PLUS GRANDE FRAUDE DE L'HISTOIRE»
- UN ARBITRE SPORTIF SIFFLE LA CAUSE DES PROBLEMES CARDIAQUES CHEZ DES ATHLETES EN PARFAITE SANTE
- BILL GATES ET JEFF BEZOS VEULENT NOUS FAIRE MANGER DE LA VIANDE CULTIVEE A PARTIR DU SANG FOETAL DE BEBE
- LES SCIENTIFIQUES CHERCHENT A CREER DES VACCINS A ARNM CHIMERIQUES POUVANT ETRE DEPLOYES DANS LES ALIMENTS
- LES « GENTILS » INTEGRES SE RETOURNENT CONTRE LA CABALE… TOUT SORT… ET LE REVEIL NE PEUT ETRE ARRETE
- LES TAUX DE CRISE CARDIAQUE MONTENT EN FLECHE ET LES MEDIAS BLAMENT TOUT AUTRE QUE LES VACCINS COVID
- LA CONSTRUCTION D'UN BIOLAB DIRIGE PAR LES ÉTATS-UNIS EN UKRAINE A ETE LANCEE PAR OBAMA
- POUTINE FIXE UNE DATE LIMITE POUR LA CHUTE DU DOLLAR
- POUTINE DECLARE LA FIN DES DEVISES OCCIDENTALES
- LE SANG DE PERSONNES VACCINEES CONTRE LE COVID CONTENAIT D'ETRANGES ARTEFACTS (OXYDE DE GRAPHENE ?)
- L'APPROVISIONNEMENT EN GAZ DE L'EUROPE POURRAIT ETRE INTERROMPU EN QUELQUES JOURS
- MODERNA, NIAID, LA FONDATION BILL & MELINDA GATES ONT AIDE A DEVELOPPER LE SRAS-COV-2
- LES GENS CONSOMMENT DESORMAIS L'EQUIVALENT D'UNE CARTE DE CREDIT DE MICROPLASTIQUES PROVENANT D'ALIMENTS CONTAMINES
- LE PENTAGONE PREVOIT D'UTILISER LES BIOLABS UKRAINIENS POUR ATTAQUER LA RUSSIE
- LA RUSSIE EST-ELLE EN TRAIN DE DECOUVRIR EN UKRAINE DES « ARMES DE DESTRUCTION MASSIVE
- DES ADOLESCENTS DEVELOPPENT DES LESIONS CARDIAQUES DES MOIS APRES AVOIR REÇU LE DEUXIEME VACCIN PFIZER
- PFIZER A EMBAUCHE 600 EMPLOYES EN RAISON D'UNE « FORTE AUGMENTATION DES RAPPORTS D'EVENEMENTS INDESIRABLES »
- COMMENT ARRETER DE RONFLER ?
- QU'EST-CE QU'UN REMEDE MAISON CONTRE LE RONFLEMENT ?
- MUTE CONTRE LE RONFLEMENT : CE QU'IL FAUT SAVOIR
- PLUS VOUS PRENEZ DE VACCINS, PLUS VOTRE SYSTEME IMMUNITAIRE S'AFFAIBLIT
- LA PANDEMIE MONDIALE DE VACCINES S'AGGRAVE
- LES LEGISLATEURS ALLEMANDS VOTENT CONTRE LE PROJET DE LOI QUI AURAIT RENDU OBLIGATOIRE LES VACCINS
- L'AMERIQUE ET UNE GRANDE PARTIE DU MONDE DEVELOPPE SONT SUR LA VOIE RAPIDE DES PENURIES
- LA NANOTECHNOLOGIE UTILISEE DANS LES VACCINS COVID, 2 000 ALIMENTS, N'EST PAS ETIQUETEE
- D'ÉNORMES NOUVELLES SUR LES VACCINS QUI ECLATENT, LE RATIONNEMENT DES PREPARATIONS POUR NOURRISSONS COMMENCE
- LE «VACCIN» COVID DE PFIZER RESPONSABLE D'UNE EPIDEMIE D'HEPATITE CHEZ LES ENFANTS
- COMBATTRE LES VIRUS NATURELLEMENT EST AUSSI SIMPLE QUE DE RESPIRER
- UNE ETUDE EXAMINE QUELLES HERBES PEUVENT LE MIEUX CONTRECARRER LE VENIN DU COBRA ROYAL
- UNE ETUDE REVELE DIFFERENTS TYPES DE GLOBULES BLANCS HUMAINS
- UTILISER UN SMARTPHONE POUR DETECTER UN VIRUS HAUTEMENT CONTAGIEUX
- L'IVERMECTINE EST UN PUISSANT REMEDE ANTICANCEREUX, CONCLUENT 9 ETUDES EVALUEES PAR DES PAIRS
- L'INTOXICATION MONDIALE EXPLIQUE LA CHUTE DE L'HUMANITE
- DES PEPTIDES DE VENIN ONT-ILS ETE INTEGRES A LA CHARGE UTILE DU VIRUS ?
- LES ÉTATS-UNIS MENENT DES RECHERCHES ILLICITES DANS DES LABORATOIRES BIOLOGIQUES UKRAINIENS
- LES CAMPS DE « QUARANTAINE » (CONCENTRATION) DE MASSE DE SHANGHAI N'ONT PAS DE DOUCHES
- LES VACCINS TUENT-ILS LES « PERSONNES DE COULEUR » DEUX FOIS PLUS QUE LES BLANCS ?
- LES LABORATOIRES UKRAINIENS D'ARMES BIOLOGIQUES SONT UNE "ENTREPRISE CRIMINELLE"
- LA CRISE DES PUCES INFORMATIQUES S'AGGRAVE
- LES VACCINS A ARNM COVID-19 CONTIENNENT UN SUBSTRAT DE VENIN DE SERPENT
- COVID-19 N'EST PAS UN VIRUS RESPIRATOIRE, C'EST UN EMPOISONNEMENT AU VENIN DE SERPENT
- LES VACCINS COVID COMME MEDICALEMENT INUTILES POUR SAUVER DES VIES
- 7 LEGUMES A CULTIVER POUR VOTRE RESERVE DE NOURRITURE
- NETTOYAGE ETHNIQUE VIA LES VACCINS COVID
- LA MAISON BLANCHE POUSSE LE SOMMET MONDIAL SUR LES VACCINS
- PFIZER ET LA FDA SAVAIENT QUE LEUR VACCIN COVID PROVOQUE UNE IMMUNOSUPPRESSION, ADE, VAED
- POUR TOUTE PERSONNE DE MOINS DE 80 ANS, LES «VACCINS» COVID SONT PLUS MORTELS QUE COVID LUI-MEME
- LES TCHEQUES RISQUENT DESORMAIS UNE PEINE DE PRISON
- LES PILOTES INFECTES PAR LE COVID SOUFFRENT D'UN ARRET CARDIAQUE
- UN PILOTE D'AMERICAN AIRLINES SUBIT UN ARRET CARDIAQUE GRAVE
- UNE ENTREPRISE DE BIOTECHNOLOGIE VEUT CONTROLER L'ESPRIT DES GENS GRACE A LA NEUROMODULATION
- LE REJET DES MESURES DE «TYRANNIE COVID»
- RESTRICTIONS DRACONIENNES IMPOSEES PAR LA CHINE
- LA GENERATION Y, LA GENERATION X ET LA GENERATION Z CONNAISSENT UNE SURMORTALITE RECORD
- SI VOUS PENSEZ QUE L'EFFONDREMENT DE LA CHAINE D'APPROVISIONNEMENT
- RESPONSABLES GOUVERNEMENTAUX ONT MANIPULE DES DONNEES
- BIG PHARMA CACHE LES ORIGINES VENOM DE SES MEDICAMENTS
- FRAUDE, NEGLIGENCE ET ACTES CRIMINELS : ZOOM SUR L'HISTOIRE SCANDALEUSE DE PFIZER
- VOICI CE QUE VOUS DEVEZ SAVOIR SUR LE DIOXYDE DE CHLORE (CLO2), "L'ANTIDOTE UNIVERSEL"
- LA POLOGNE N'ACCEPTERA PLUS NI NE PAIERA LES FUTURES LIVRAISONS DE VACCINS COVID-19
- LA POLOGNE ANNONCE DES MESURES POUR INFLIGER DES AMENDES AUX ENTREPRISES DE MEDIAS SOCIAUX
- LE FMI AVERTIT QUE LES PENURIES ALIMENTAIRES VONT CREER DES TROUBLES SOCIAUX
- LES IMMUNODEPRIMES N'ETAIENT JAMAIS CENSES ETRE «VACCINES»
- LE CANADA A UTILISE LA PANDEMIE POUR S'ALIGNER SUR L'AGENDA DE DAVOS
- LES COMPLICATIONS DU VACCIN COVID VONT BIENTOT « EFFONDRER NOTRE SYSTEME DE SANTE »
- INCIDENTS CARDIOVASCULAIRES CHEZ LES ADOLESCENTS
- VACCIN PFIZER A PROVOQUE UNE AUGMENTATION MASSIVE DES FAUSSES COUCHES ET DES BEBES MORT-NES
- LES VACCINS COVID ONT INSTALLE DES « CHARGES UTILES » DE MARBURG CHEZ LES VICTIMES HUMAINES
- LES DONNEES DU VAERS ASSOCIENT LES VACCINS COVID-19 A UNE AUGMENTATION CHOQUANTE DES DECES FŒTAUX
- TRIPLE INJECTION 500 % PLUS SUSCEPTIBLE D'"ATTRAPER" LE COVID
- LE VACCIN COVID-19 DE PFIZER AVAIT UN TAUX DE MORT CHOQUANT DE 3,7 % AU DEBUT DE L'ESSAI
- LE « TRAITE SUR LA PANDEMIE » DE L'OMS DETRUIRA TOUTES LES LIBERTES
- LES «VACCINS» A ARNM COVID AUGMENTENT LE RISQUE DE MYOCARDITE
- DES PROTEINES DE POINTE TOXIQUES CAUSENT DES DOMMAGES TISSULAIRES
- LE VIRUS DE MARBURG A PEUT-ETRE ETE LIBERE VIA DES CHARGES
- COVID ET LA PLANDEMIE SONT TOUS UNE QUESTION DE CONTROLE DE LA POPULATION
- L'ITALIE DEPLOIE UN NOUVEAU SYSTEME DE CREDIT SOCIAL
- MICROCHIP IMPLANTE A LA MAIN COMPREND UNE ANTENNE UTILISEE POUR SUIVRE LES PAIEMENTS
- LES APPLICATIONS BIG TECH CONTINUENT A "ECOUTER" ET A COLLECTER DES DONNEES MEME LORSQUE LE MICRO EST REGLE SUR "MUET"
- LA NOUVELLE UNITE DE « DESINFORMATION » DU DHS EST CONÇUE POUR DIFFUSER LA DESINFORMATION
- BILL GATES DEVELOPPE UN NOUVEAU VACCIN QUI PRETEND PREVENIR LA POLIOMYELITE
- L'INDUSTRIE DE L'AVORTEMENT POUSSE LA PILULE CHIMIQUE A AFFAMER LE FŒTUS
- LES «VACCINS» COVID PROVOQUENT UNE HEPATITE AUTO-IMMUNE SEVERE CHEZ LES ENFANTS
- BLACKROCK ET VANGUARD PRENNENT LE CONTROLE DES TECHNOLOGIES DE PRODUCTION ALIMENTAIRE
- COMMENT FAUCI A FACILITE LA TRAHISON ENTRE LES ÉTATS-UNIS ET LA CHINE COMMUNISTE
- LES SAISIES ONT DEJA COMMENCE A AUGMENTER
- UN AVIATEUR COMBAT UN EVENTUEL RENVOI POUR AVOIR REFUSE DE SE FAIRE VACCINER CONTRE LE CAILLOT COVID
- 74,2 MILLIONS DE PERSONNES VIVANT AUX ÉTATS-UNIS N'ONT JAMAIS ETE «VACCINEES» POUR COVID
- LES CHERCHEURS CONFIRMENT LES PREUVES DE L'EXCRETION VIRALE DES VACCINS COVID-19
- LE MEILLEUR AVOCAT DE TWITTER PLEURE LITTERALEMENT LORS D'UNE REUNION VIRTUELLE
- AMERICAINS COMMENCENT A DEMANDER APRES PLUSIEURS FAUX DRAPEAUX
- LE CDC A DEPENSE 420 000 $ POUR SUIVRE LES AMERICAINS QUI ONT VIOLE LE VERROUILLAGE
- BIDEN QUI A RECEMMENT LANCE UN « MINISTERE DE LA DESINFORMATION »
- DES DEMONS DE GAUCHE HURLANTS APPELLENT A UNE VIOLENCE CIBLEE CONTRE LES JUGES DE LA HAUTE COUR
- PILULES ABORTIVES FAITES MAISON A BASE DE MEDICAMENTS CONTRE LES ULCERES DE L'ESTOMAC UTILISES CHEZ LES ANIMAUX
- LE CONCURRENT DE NEURALINK, SYNCHRON, LANCE DES ESSAIS SUR L'HOMME
- TWITTER DOIT EXPLIQUER POURQUOI IL A CENSURÉ LE JOURNALISTE ALEX BERENSON
- LE FBI A SURVEILLE LES DONNEES DE 3,4 MILLIONS D'AMERICAINS SANS MANDAT
- BIDEN UTILISE LE THEATRE DE GUERRE UKRAINIEN POUR ÉLIMINER L'ARSENAL DE MUNITIONS AMERICAIN
- LES GAUCHISTES SONT EN COLERE QUE LES « GROSSESSES »
- ACHETEZ CHEZ AMAZON, ASSASSINEZ UN ENFANT
- LE STOCKAGE DE GAZ EN ALLEMAGNE ATTEINT DES NIVEAUX RECORD
- LES EFFETS NOCIFS DES VACCINS COVID-19 S'EXPLIQUENT MIEUX PAR LES MICRO-CAILLOTS SANGUINS
- TOP 10 DES THEORIES DU COMPLOT "SCIENTIFIQUES" EN PLEIN EFFET EN CE MOMENT
- LES VACCINS A ARNM CONTINUERONT DE TUER DES GENS
- 7 CHOSES DONT VOUS AVEZ BESOIN POUR UNE VIE HORS RESEAU SANS TRACAS
- ETUDE MONTRE QUE LA SUPPLEMENTATION EN VITAMINES AIDE A PREVENIR L'INFECTION AU COVID
- NOUVELLES PREUVES SOLIDES QUE LA VITAMINE D A UNE CAPACITE UNIQUE A REPOUSSER LE COVID
- L'ARNM DES VACCINS COVID-19 PENETRE DANS LES CELLULES HEPATIQUES ET MODIFIE L'ADN HUMAIN
- LE LABORATOIRE DE WUHAN A ORDONNE A UN PARTENAIRE BASE AUX ÉTATS-UNIS DE DETRUIRE DES PREUVES
- 5 HERBES PUISSANTES QUI PEUVENT GARDER VOTRE SYSTEME RESPIRATOIRE EN BONNE SANTE
- RENCONTREZ LES BRANCH COVIDIANS
- PAYPAL SAISIT DESORMAIS LES COMPTES APPARTENANT A DES MEDIAS INDEPENDANTS
- CAILLOTS SANGUINS :ALIMENTS ET HERBES CURATIFS
- BIG PHARMA PAIERA DES CENTAINES DE MILLIONS DE DOLLARS
- MALADIES CARDIOVASCULAIRES :ALIMENTS CURATIFS
- ALORS QUE NBC APPELLE ELON MUSK UN DANGER
- PAYPAL SAISIT DESORMAIS LES COMPTES APPARTENANT A DES MEDIAS INDEPENDANTS
- NETFLIX EST SUR LE POINT DE FAIRE FACE A UN JUGEMENT DEVANT UN TRIBUNAL FEDERAL
- COVID EST LA PLUS GRANDE EXPERIENCE DE CONFORMITE ASCH JAMAIS MENEE
- ACHETEZ UNE PAIRE DE LEVI'S, AIDEZ A ASSASSINER UN ENFANT A NAITRE
- LA PHYTOTHERAPIE MTC QUI ARRETE LE CANCER DU POUMON DANS SON ELAN
- HYPERTENSION ARTERIELLE:ALIMENTS ET HERBES PRECONISES
- DEGENERESCENCE MACULAIRE ALIMENTS ET HERBRES PRECONISES
- SIX REMEDES NATURELS PEU CONNUS CONTRE LES ACOUPHENES
- HEPATITE ALIMENTS CURATIFS ET HERBES PRECONISES
- HERBES MEDICINALES POUR LA PERTE DE MEMOIRE
- LA VACCINATION DE MASSE CONTRE LE COVID-19 EST UNE POLITIQUE MORTELLE
- LES MANDATS DE VACCINATION ET LES BLESSURES CAUSEES PAR LES VACCINS MILITAIRES
- 5 MALADIES PLUS MORTELLES SIGNALEES DANS LE MONDE
- TAUX DE MORTALITE TOUTES CAUSES CONFONDUES 52 FOIS PLUS ELEVE CHEZ LES ENFANTS VACCINES
- LES DECES DUS AU VACCIN FONT LEUR APPARITION
- LES NANOPARTICULES LIPIDIQUES DANS LES PIQURES DE COVID
- PFIZER ADMET QU'IL NE PEUT PROBABLEMENT PAS DEMONTRER UNE EFFICACITE OU UNE SECURITE SUFFISANTE DE SES VACCINS
- PRUDENTIAL FINANCIAL,, MET OFFICIELLEMENT FIN A L'EXIGENCE DE PIQURE COVID
- LA FDA ADMET QUE COVID VACCINS CAUSER DES CAILLOTS DE SANG
- EN BONNE SANTE GORILLE MEURT DE DEFAILLANCE MULTIVISCERALE SUIVANTES COVID LA VACCINATION
- LE DIRECTEUR PAR INTERIM DES NIH ADMET L'APPARENCE D'UN CONFLIT D'INTERETS
- LE MEURTRE PAR LA CHINE DE PRISONNIERS D'OPINION POUR LEURS ORGANES EST UN " OUTIL DE GENOCIDE "
- L'IVERMECTINE EST-ELLE UNE SOLUTION CONTRE LE CANCER ?
- L'IVERMECTINE EST-ELLE UNE SOLUTION CONTRE LE CANCER ?
- APPRENEZ A FABRIQUER VOTRE PROPRE LAIT MATERNISE BIEN PLUS SAIN QUE LE LAIT MATERNISE ACHETE EN MAGASIN
- LE PENTAGONE A MENE DES EXPERIENCES MEURTRIERES D'ARMES BIOLOGIQUES
- ANCIEN GENERAL CANADIEN CAPTURE EN UKRAINE PAR LES FORCES RUSSES
- L'ALLEMAGNE SIGNALE UNE BAISSE MASSIVE DU GAZ RUSSE
- LA COMMISSION EUROPEENNE VA INTENSIFIER LA SURVEILLANCE EN LIGNE
- UN DOCUMENT DE DENONCIATION MONTRE A QUEL POINT LE FBI CORROMPU A «SURVEILLE» CERTAINS MEDIAS D'INFORMATION
- DISNEY PAIERA LES AVORTEMENTS DES EMPLOYES
- BIDEN WHITE HOUSE ADOPTE DESORMAIS LE PIRATAGE
- L'AUTEUR DE SLATE A ENVOYE L'ARTICLE A SUCCES
- OBAMA PRETEND QUE LES GENS « MEURENT DE DESINFORMATION »
- LA CALIFORNIE VA COMMENCER A VACCINER LES ENFANTS DE 12 ANS SANS LE CONSENTEMENT PARENTAL
- PFIZER ANNONCE UNE PUCE TRAÇABLE DANS LES PILULES
- MONKEYPOX EST LE PROCHAIN "SCARIANT" QUI SE DECHAINE SUR LE MONDE POUR EXIGER LA CONFORMITE AUX VACCINS
- UNE PANDEMIE DE CONTRÔLE SUR LES GENS PLUTOT QU'UNE PROPAGATION DE VIRUS
- LE CDC ADMET AVOIR DELIBEREMENT CACHE AU PUBLIC DES DONNEES INCRIMINANTES SUR LES VACCINS
- UN EX-FLIC TUE DANS UNE FUSILLADE A BUFFALO VENAIT D'INVENTER UN PUISSANT "MOTEUR A EAU"
- DR PETER MCCULLOUGH : INUTILE DE PANIQUER A PROPOS DE LA VARIOLE DU SINGE
- BILL GATES, LE PLAN DU BIOTERRORISTE POUR UN CONTROLE MONDIAL
- UN JEUNE GARÇON EST DECEDE AVEC DES SIGNES D'INFLAMMATION CARDIAQUE APRES LA VACCINATION CONTRE LE COVID-19: CDC
- BIDEN CRIME FAMILY TIRERA DES BENEFICES MASSIFS DES VACCINS CONTRE LA VARIOLE DU SINGE
- LE TIREUR DE BUFFALO A-T-IL ETE PREPARE PAR LE FBI POUR COMMETTRE UN MEURTRE DE MASSE ?
- LES MARECHAUX FEDERAUX ONT MENOTTE MAMAN POUR AVOIR TENTE DE SAUVER SES ENFANTS
- LA PANDEMIE DE COVID-19 N'A JAMAIS ETE CE QU'ILS PRETENDAIENT, MAIS LA PANDEMIE DE VACCIN EST RÉELLE
- LA RUSSIE RENFORCERA SES LIENS ECONOMIQUES AVEC LA CHINE MALGRE LES SANCTIONS IMPOSEES PAR LES PAYS OCCIDENTAUX
- LES FEMMES ENCEINTES SONT EXPOSEES A DES PRODUITS CHIMIQUES INDUSTRIELS PLUS DANGEREUX, AVERTISSENT LES CHERCHEURS
- LE RESPONSABLE AUSTRALIEN DE LA SECURITE EN LIGNE APPELLE A UN "RECALIBRAGE" DE LA "LIBERTE D'EXPRESSION"
- LES PERSONNES "COMPLETEMENT VACCINEES" CONTRE LE COVID DEVELOPPENT LE SIDA
- KLAUS SCHWAB LANCE UNE MENACE AU PRESIDENT BRESILIEN POUR AVOIR REFUSE DE SIGNER LE TRAITE DE L'OMS
- MONKEYPOX EST UNE DISSIMULATION (DISTRACTION ?) POUR LES EVENEMENTS INDESIRABLES DU "VACCIN" COVID, Y COMPRIS LE SIDA
- L'ARIZONA INTERDIT LES VACCINS OBLIGATOIRES CONTRE LE COVID-19
- LES JARDINS EN TEMPS DE GUERRE SONT ESSENTIELS
- LA DIMINUTION DE L'APPROVISIONNEMENT EN BLE POURRAIT DECLENCHER UNE FAMINE MONDIALE
- L'AVOCAT DU LANCEUR D'ALERTE : PFIZER S'EN EST TIRE AVEC UNE FRAUDE VACCINALE PARCE QUE LE GOUVERNEMENT ETAIT CO-CONSPIRATEUR
- LIEN ENTRE LA CONSOMMATION D'HUILE D'OLIVE ET LA REDUCTION DU RISQUE DE MALADIE CARDIAQUE ET D'ALZHEIMER
- ALIBABA DEVELOPPE UNE TECHNOLOGIE CAPABLE DE SUIVRE L'EMPREINTE CARBONE
- LE DR ROBERT MALONE FUSTIGE LES MEDIAS GRAND PUBLIC POUR AVOIR REPANDU DES MENSONGES SUR LA VARIOLE DU SINGE
- L'EPIDEMIE DE VARIOLE DONT BILL GATES AVAIT AVERTI IL Y A QUELQUES MOIS SE DECHAINE
- LE «VACCIN» COVID D'ASTRAZENECA AUGMENTE LE RISQUE DE GUILLAIN-BARRE ET D'AUTRES AFFECTIONS NEUROLOGIQUES
- ASTAXANTHINE : L'ANTIOXYDANT LE PLUS PUISSANT DE MERE NATURE
- UN NEUROCHIRURGIEN A LA RETRAITE DENONCE LES GOUVERNEMENTS
- THOMAS RENZ POURSUIT LES MONDIALISTES QUI ONT PERPETRE LA PANDEMIE DE COVID-19 EN UTILISANT LEURS PROPRES MOTS CONTRE EUX
- L'OMS S'ASSOCIE A UNE SOCIETE ALLEMANDE POUR CREER UNE APPLICATION MONDIALE DE PASSEPORT POUR LE VACCIN COVID-19
- L'ARMEE AMERICAINE SURPRISE EN TRAIN D'ADMINISTRER DE MANIERE TROMPEUSE LE VACCIN
- LES VACCINS COVID RENDENT LES GENS PLUS VULNERABLES A LA MALADIE
- LES ENSEIGNANTS DU PRESCOLAIRE DE CAROLINE DU NORD ONT MONTRE AUX ENFANTS DES CARTES FLASH
- LORSQUE LES "VERIFICATEURS DE FAITS" DEVIENNENT DES FUGITIFS
- LE PRESIDENT DU GEANT PHARMACEUTIQUE EUROPEEN A MENTI SUR LE STATUT DE VACCINATION COVID
- UNE MERE CHIMPANZEE SOIGNE UNE BLESSURE A SON FILS AVEC UN INSECTE
- LES INJECTIONS COVID DE PFIZER TUENT DES GENS, Y COMPRIS DES BEBES
- UNE PILULE ABORTIVE SOI-DISANT «SURE»
- L'OMS DECLARE QU'IL EST PEU PROBABLE QUE L'EPIDEMIE DE MONKEYPOX SE TRANSFORME EN PROCHAINE PANDEMIE MONDIALE
- UN SCEPTICISME SAIN EST APPROPRIE LORSQUE L'ON CONSIDERE LA VARIOLE DU SINGE
- LA MALADIE DES GENCIVES AUGMENTE LE RISQUE DE DEVELOPPER UNE MALADIE MENTALE
- LA METHODE DE JARDINAGE MITTLEIDER AUGMENTE LE RENDEMENT DE MANIERE RENTABLE
- UN PATIENT HORRIFIE DIT QUE LES MEDECINS ONT LAISSE UN TUBE RESPIRATOIRE DANS SON CORPS PENDANT 30 ANS
- ÉTUDE : IL N'Y A PAS DE COVID « LONG »
- UN MEDECIN CANADIEN EST INDEMNE
- LES PANNES D'ELECTRICITE HIVERNALES AU ROYAUME-UNI SONT IMMINENTES
- META MADNESS : LE FORUM ECONOMIQUE MONDIAL JOUERA UN ROLE DE PREMIER PLAN DANS LE METAVERSE
- LA CURCUMINE RALENTIT LA PROGRESSION DE LA MALADIE RENALE CHRONIQUE
- DES EXPERTS DECOUVRENT UNE ARMURE UNIQUE EN ECAILLES DE CUIR
- LES MONDIALISTES ENTRENT DANS LA PHASE DE MORT DE L'EXTERMINATION HUMAINE
- UNE MERE CHIMPANZEE SOIGNE UNE BLESSURE A SON FILS AVEC UN INSECTE
- L'ECOLE PUBLIQUE DE CHICAGO ANNONCE DES NOTES SUPÉRIEURES AUTOMATIQUES POUR LES ETUDIANTS NOIRS
- CES SUBSTANCES NATURELLES NEUTRALISENT LES PROTEINES DE POINTE DU VACCIN COVID
- MEDIAS NATIONAL-SOCIALISTES : CE N'EST QU'UNE COÏNCIDENCE SI NOUS VOULONS CONFISQUER LES ARMES COMME LES NAZIS
- LA NORVEGE LANCE UN NOUVEAU SYSTEME DE SURVEILLANCE POUR SUIVRE TOUS LES ACHATS ALIMENTAIRES DES PARTICULIERS
- LES «VERIFICATEURS DE FAITS» POLITIFACT SONT DES POLICIERS DE LA PENSEE A FAIBLE QI
- LES DECES SUBITS DUS AUX VACCINS SONT MAINTENANT SI COURANTS
- LES PROPRES DOCUMENTS DE PFIZER ADMETTENT QUE LES VACCINS COVID A ARNM ENTRAINERONT UNE DEPOPULATION MASSIVE
- LE GOUVERNEMENT ESPAGNOL ADMET AVOIR PULVERISE DES CHEMTRAILS SUR LES CITOYENS, A LA DEMANDE DE L'ONU
- LES PROPRES DONNEES DE MODERNA PROUVENT QUE LE RAPPEL DE VACCIN SPECIFIQUE A OMICRON FONCTIONNE A PEINE
- UN HAUT RESPONSABLE UKRAINIEN ADMET AVOIR MENTI AU SUJET DE RUSSES VIOLANT DES UKRAINIENS
- LE GROS BONNET DE L'INDUSTRIE PHARMACEUTIQUE ESPAGNOLE ACCUSE D'AVOIR SIMULE LE STATUT DE VACCINATION CONTRE LE COVID
- BANQUE MONDIALE : L'ECONOMIE MONDIALE DEVRAIT S'EFFONDRER CETTE ANNEE
- LA RUSSIE VIENT D'INTRODUIRE UNE NOUVELLE LOI CRIMINALISANT LA "PROPAGANDE LGBT"
- DES MEDECINS POURSUIVENT LA FDA POUR AVOIR FAIT CAMPAGNE CONTRE L'UTILISATION DE L'IVERMECTINE POUR TRAITER LE COVID-19
- REP. JORDANIE : LE FBI PUNIT LES EMPLOYES QUI ONT DES OPINIONS CONSERVATRICES, SELON LES DENONCIATEURS
- LE MOIS PRIDE DEMARRE AVEC L'EPIDEMIE DE MONKEYPOX DANS LA COMMUNAUTE HOMOSEXUELLE
- REDUISEZ LE GASPILLAGE ALIMENTAIRE EN APPRENANT A CONSERVER CORRECTEMENT LES FRUITS ET LEGUMES FRAIS
- UN TYPE DE VITAMINE E PRESENT DANS LES NOIX AIDE A PREVENIR LES CRISES D'ASTHME
- UNE ETUDE MONTRE QUE L'APIGENINE, UN COMPOSE DU PERSIL, OFFRE DES AVANTAGES CONTRE LE CANCER
- LA RESURGENCE DU COVID-19 A L’AUTOMNE SERA CAUSEE PAR DES PERSONNES VACCINEES
- PHOTOS DE MICROSCOPIE CHOQUANTES DE CAILLOTS SANGUINS EXTRAITS DE CEUX QUI SONT « MORTS SUBITEMENT »
- DES JEUNES EN BONNE SANTE MEURENT MAINTENANT EN MASSE
- PLUS DE LA MOITIE DE TOUS LES NOUVEAUX CAS DE MONKEYPOX DETECTES CHEZ LES HOMMES HOMOSEXUELS : DONNEES
- LES MEMES MEDICAMENTS UTILISES POUR CASTRER CHIMIQUEMENT LES PEDOPHILES SONT MAINTENANT DISTRIBUES AUX ENFANTS
- UN ALLIE DE VLADIMIR POUTINE DIT QUE LA POLOGNE SE PREPARE A ANNEXER UNE PARTIE DE L'UKRAINE
- L'ADRENOCHROME ETAIT UNE "THEORIE DU COMPLOT?
- SI LA RUSSIE COUPE L'APPROVISIONNEMENT EN URANIUM ENRICHI DES COMPAGNIES D'ELECTRICITE AMERICAINES
- L'UKRAINE EST A COURT DE MUNITIONS ALORS QUE LA RUSSIE CONTINUE DE DOMINER SON ARMEE
- LA NOUVELLE-ZELANDE ENVISAGE DE TAXER LES AGRICULTEURS POUR LES ROTS ET LES PETS DE LEURS ANIMAUX
- NATTOKINASE DISSOUT LES CAILLOTS SANGUINS ET EMPECHE LA FORMATION DE NOUVEAUX CAILLOTS
- CAILLOTS DE «BIOSTRUCTURE ARTIFICIELLE» PRELEVES SUR DES VICTIMES DECEDEES DE VACCINS COVID
- LES EXAMENS POST-MORTEM REVELENT DES BIOSTRUCTURES MASSIVES DE CAILLOTS SANGUINS DANS LES CORPS DES VACCINES
- “COBAYE HUMAIN” DE BLESSURES ET DE DECES A PARTIR DE COVID INJECTIONS DE CONTINUER A MONTER
- POURQUOI LES AVIONS MILITAIRES CONTINUENT-ILS DE TOMBER DU CIEL ? UNE NOUVELLE ANALYSE APPORTE DES REPONSES
- ÉNORME DÉCOUVERTE : UNE AUGMENTATION DU CO2 REND LES CULTURES VIVRIERES ET LES HERBES PLUS NUTRITIVES ET MEDICINALES
- L'OMS ENQUETE SUR DES CAS DE VIRUS MONKEYPOX DANS LE SPERME
- HISTOIRE REVELANT QUE LE COVID-19 GRAVE EST RAREMENT TROUVE CHEZ LES NON VACCINES
- USA TODAY SUPPRIME 23 ARTICLES APRES QU'UNE ENQUETE A TROUVE DES SOURCES FABRIQUEES PAR UN JOURNALISTE
- QUATRE-VINGT POUR CENT DE CEUX QUI MEURENT DE « COVID » AU CANADA SONT COMPLETEMENT PIQUEES
- LES VACCINS COVID LIEES A UNE AUGMENTATION DES «POSSESSIONS DEMONIAQUES», SELON LES CHEFS RELIGIEUX
- LES DONNEES DU VAERS MONTRENT UNE AUGMENTATION DE 2 000 %
- LA CHINE UTILISE DE FAUX TESTS COVID COMME EXCUSE
- LES HUMAINS SONT DESORMAIS DES ANIMAUX PIRATABLES
- OWEN SHROYER EXPOSE DE VRAIS COMPLOTS SUR LES INJECTIONS DE CAILLOTS COVID
- DES ENFANTS EN CHINE REÇOIVENT UN DIAGNOSTIC DE DIABETE APRES AVOIR REÇU DES VACCINS
- DEUX JUGES SE RETIRENT DU PROCES DE NEW YORK SUR LES MANDATS DU VACCIN COVID POUR CONFLITS D'INTERETS
- LES DEMANDES DE DECES EN HAUSSE DE 6 MILLIARDS DE DOLLARS
- LIEN POSSIBLE ENTRE LE DIAGNOSTIC DE NEUROMYELITE OPTIQUE APRES LA VACCINATION CONTRE LE COVID-19
- LE SYNDROME DE LA MORT SUBITE DE L'ADULTE
- LA VACCINATION AUGMENTE LE RISQUE COVID, MAIS UNE INFECTION SANS VACCINATION CONFERE UNE IMMUNITE
- LA RADIOTHERAPIE CAUSE LE CANCER, LA MYRTILLE LE TUE
- LES PILOTES PARLENT DES BLESSURES ET DES DECES INDUITS PAR LES VACCINS
- NE LISEZ PAS CECI SI VOUS ETES VACCINE
- HOMMES HOMOSEXUELS DE SE MASTURBER A SIX PIEDS DE DISTANCE
- VACCINS A PROPAGATION AUTOMATIQUE : LES SCIENTIFIQUES CREENT DES VACCINS QUI SE PROPAGENT COMME UNE MALADIE
- LES « VACCINS » COVID DEVASTENT LE NOMBRE DE SPERMATOZOÏDES CHEZ LES HOMMES
- LE MAGAZINE SCIENCE ADMET QUE LES «VACCINS» COVID SONT INUTILES ET NOCIFS
- LES VACCINS COVID-19 REACTIVENT LE VIRUS DE LA VARICELLE CHEZ LES VACCINES
- UN NAGEUR SYNCHRONISE CHAMPION PERD CONNAISSANCE ET COULE AU FOND
- POUTINE ANNONCE UN NOUVEAU PROJET DE MONNAIE DE RESERVE MONDIALE BRICS
- LES COMPOSES DE MANDARINE PROTEGENT CONTRE UNE LONGUE LISTE DE MALADIES CHRONIQUES
- LE TRUC SIMPLE POUR MANGER QUI POURRAIT PREVENIR LA PLUPART DES MALADIES, Y COMPRIS LA CECITE
- LE ROYAUME-UNI INDEMNISE LES VICTIMES DU «VACCIN» COVID
- VACCINER LES ENFANTS CONTRE LE COVID ETAIT UNE ERREUR
- TOUS LES VACCINS COVID DETRUISENT L'IMMUNITE NATURELLE
- 97,8 % DES FUSILLADES DE MASSE SONT LIEES A CELA
- LE DIRECTEUR DE L'AUDIT ET LES RESPONSABLES MARKETING DE FACEBOOK TRAVAILLAIENT TOUS CHEZ PFIZER
- LA FAUSSE "VIANDE" CULTIVEE EN LABORATOIRE ET CHARGEE D'OGM EST UNE ABOMINATION TOXIQUE A EVITER A TOUT PRIX
- PUBLIX REFUSE D'ADMINISTRER DES "VACCINS" COVID
- LIEN ENTRE LES VACCINS COVID-19 ET DES TAUX D'INFECTION ET DE DECES PLUS ÉLEVÉS EN AUSTRALIE
- LES GOUVERNEMENTS METTRONT LEUR PEUPLE DANS UNE PSYCHOSE DE FORMATION DE MASSE
- UNE ALIMENTATION A BASE DE PLANTES PEUT AIDER A TRAITER LA DYSFONCTION ERECTILE
- LE VACCIN COVID PEUT-IL AFFECTER LA FERTILITE
- UN SCIENTIFIQUE DECOUVRE UNE PROTEINE ANTI-AGE QUI POURRAIT RALENTIR - VOIRE ARRETER - LE PROCESSUS DE VIEILLISSEMENT
- NOURRITURE MEDICINALE : LA BAIE D'ARONIA A UN EFFET ANTI-DIABETIQUE
- LE RONFLEMENT EST-IL PLUS DANGEREUX POUR VOTRE CŒUR QUE FUMER
- LE PDG DE PFIZER DECLARE QUE LES VACCINS COVID ANNUELS POUR LES AMERICAINS SONT «PRESQUE CERTAINS»
- LES « VACCINS » COVID-19 SONT UNE THERAPIE GENIQUE
- LES SCIENTIFIQUES DISENT QUE LE CELERI PEUT AIDER A PREVENIR ET A TRAITER LE CANCER
- LA VITAMINE D EST CRUCIALE POUR VOTRE SANTE METABOLIQUE
- LE CDC A DELIBEREMENT DISSIMULE LA VERITE AU PUBLIC SUR LES VACCINS COVID CAUSANT DES CAILLOTS SANGUINS MORTELS
- LE DEPLOIEMENT DU VACCIN EST DIRECTEMENT LIE AU HANDICAP
- POUTINE DIT QUE LES PAYS BRICS ETABLISSENT UNE NOUVELLE MONNAIE POUR REMPLACER LE DOLLAR AMERICAIN
- LES VACCINS COVID-19 PROVOQUENT UNE INFLAMMATION GRAVE
- UNE ETUDE ISRAELIENNE MONTRE QUE LES VACCINS COVID-19 FONT CHUTER LE NOMBRE DE SPERMATOZOÏDES
- 3 FAÇONS SIMPLES DE DESINFECTER L'AIR DE VOTRE MAISON AVEC DES HUILES ESSENTIELLES
- LE DIOXYDE DE CHLORE AIDE LES PATIENTS COVID A GUERIR ET A SE RETABLIR
- LES ELITES MONDIALES ONT CONDUIT LA PROPAGATION DU COMMUNISME DANS LE MONDE
- LA VACCINATION CONTRE LA COVID-19 REACTIVE UN VIRUS HAUTEMENT CONTAGIEUX
- ANALGESIQUE NATUREL AVEC UNE PUISSANTE CAPACITE A ELIMINER LES CAILLOTS SANGUINS ET LES TISSUS MORTS
- L'ONU AVERTIT QUE LA PIRE FAMINE DE L'HISTOIRE EST EN TRAIN D'EMERGER
- UNE FEMME QUI A LUTTE CONTRE UN CANCER DU SANG PENDANT 5 ANS SE RETABLIT GRACE AU CURCUMA
- LE VACCIN MODERNA AUGMENTE LE RISQUE DE MYOCARDITE DE 44 FOIS CHEZ LES JEUNES ADULTES : ETUDE EVALUEE PAR DES PAIRS
- CDC PRETEND QUE L'HOMOSEXUALITE N'EST PAS A BLAMER POUR MONKEYPOX
- UN LANCEUR D'ALERTE REVELE QUE L'OBJECTIF PRINCIPAL DE PFIZER EST D'ARMER LE SYSTEME IMMUNITAIRE POUR QU'IL SE TUE
- LES CERISES PEUVENT AIDER A COMBATTRE LES MALADIES CARDIAQUES, LE DIABETE ET D'AUTRES MALADIES INFLAMMATOIRES
- L'ONU AVERTIT QUE LA PIRE FAMINE DE L'HISTOIRE EST EN TRAIN D'EMERGER
- LE MIEL DE MANUKA COMBAT LES BACTERIES RESISTANTES AUX ANTIBIOTIQUES ET BIEN PLUS ENCORE
- LES DEMOCRATES ESSAIENT MAINTENANT DE CRIMINALISER QUICONQUE N'EST PAS D'ACCORD AVEC LE TRANSGENRE
- DES MILLIONS DE PERSONNES SONT DESORMAIS HANDICAPÉES A CAUSE DES VACCINS COVID, SELON LES DONNEES
- LES VACCINS COVID-19 CAUSENT LE DIABETE DE TYPE 1
- 3 ALIMENTS A MANGER POUR ELOIGNER LES MOUSTIQUES
- 5 INGREDIENTS NATURELS QUI AGISSENT COMME UN ANTI-MOUSTIQUE
- HACKS DE LUTTE ANTIPARASITAIRE SHTF POUR LES POUX, LES MOUSTIQUES ET LES TIQUES
- 5 PLANTES QUI PEUVENT ELOIGNER LES MOUSTIQUES DE VOTRE MAISON
- COMMENT FABRIQUER SOI-MEME DES REPULSIFS ANTI-MOUSTIQUES NON TOXIQUES AVEC DES HUILES ESSENTIELLES
- BILL GATES VEUT DEPLOYER DES MOUSTIQUES GENETIQUEMENT MODIFIES POUR INJECTER DES VACCINS
- VOUS POUVEZ DESACTIVER VOS GENES CANCEREUX - VOICI COMMENT
- MALADIES CEREBRALES LES PLUS MORTELLES CONNUES DE L'HOMME EST UN «EFFET SECONDAIRE» DES VACCINS COVID
- UNE CARENCE EN VITAMINE D PROVOQUE LA DOULEUR AU BAS DU DOS CHEZ LES FEMMES MENOPAUSEES
- PFIZER A CLASSE PRESQUE TOUS LES EFFETS INDESIRABLES GRAVES LORS DES ESSAIS DE VACCINS COVID COMME « NON LIES AUX INJECTIONS »
- LE PARLEMENT EUROPEEN DECLARE QUE LES COMBUSTIBLES FOSSILES SONT UNE ENERGIE "VERTE"
- LE MINISTRE CANADIEN DE LA SANTE DIT QUE VOUS NE SERAI JAMAIS “COMPLETEMENT VACCINES”
- UNE ETUDE QATARIENNE REVELE QUE LES VACCINS A ARNM DIMINUENT EN FAIT L'IMMUNITE CONTRE LE COVID-19
- LES MONDIALISTES AUX PAYS-BAS CIBLENT LES FERMES POUR ATTEINDRE DELIBEREMENT LA FAMINE MONDIALE
- LE GAZ NATUREL VA ETRE RATIONNE EN SUISSE, AVERTIT LE GOUVERNEMENT
- LE COMPLOT CRIMINEL COVID ECLATE EN TEMPS REEL
- LE GOUVERNEMENT ISRAELIEN A CACHE LES BLESSURES DES VACCINS INFANTILES LORS DU PROCESSUS D'APPROBATION DU VACCIN COVID
- SUIVRE UN REGIME MEDITERRANEEN POURRAIT REDUIRE LA MALADIE D'ALZHEIMER ET LE DIABETE JUSQU'A 50 %
- 2 A 3 TASSES DE CAFE PAR JOUR PEUVENT REDUIRE LE RISQUE DE LESIONS RENALES DE 23 %
- L'OMS SIGNALE 2 NOUVEAUX DECES DUS AU MONKEYPOX ET DES CAS DANS DE NOUVELLES REGIONS
- LA FRAUDE DE LOUIS PASTEUR ET L'HISTOIRE ENTIEREMENT CORROMPUE DE LA VIROLOGIE
- IL A FALLU LA GUERRE RUSSE EN UKRAINE POUR REVELER L'ARNAQUE DE L'ENERGIE "VERTE"
- L'ONU SE VANTE DES PRETENDUS "AVANTAGES" DE WORLD HUNGER DANS UN EDITORIAL MAINTENANT SUPPRIME
- EXCES DE VITAMINE D : UN HOMME HOSPITALISE APRES AVOIR PRIS 8 FOIS LA QUANTITE RECOMMANDEE
- LE VACCIN COVID NE FONCTIONNE PAS. VOICI POURQUOI
- IMMUNITE NATURELLE EFFICACE A 97 % CONTRE LE COVID-19 SEVERE APRES 14 MOIS
- LES STARTUPS DE LA SANTE NUMERIQUE MANQUENT DE CREDIBILITE CLINIQUE, LA MOITIE N'EST PAS FIABLE
- LES GOUVERNEMENTS QUI ONT IMPOSE DES VACCINS MORTELS REPROCHENT DESORMAIS AUX MÉDECINS
- LE VIRUS MONKEYPOX A ETE MANIPULÉ DANS UN LABORATOIRE ET LIBERE INTENTIONNELLEMENT
- PFIZER DEMANDE AU TRIBUNAL DE REJETER LE PROCES DU LANCEUR D'ALERTE
- L'UNION EUROPEENNE ADMET ENFIN QUE LES VACCINS COVID-19 DÉTRUISENT VOTRE SYSTEME IMMUNITAIRE
- LES DONNEES DU GOUVERNEMENT BRITANNIQUE PROUVENT QUE LES VACCINS COVID-19 CONTINUENT D'ENDOMMAGER LE SYSTEME IMMUNITAIRE
- UN EXPERT CANADIEN DE L'ARNM SUSPENDU POUR AVOIR CRITIQUE LE VACCIN COVID POUR LES ENFANTS
- L'INDUSTRIE TECHNOLOGIQUE DEVELOPPE UNE TECHNOLOGIE DE LECTURE DE PENSEES PAR IA
- '90% BOTS' : ELON MUSK REVELE QUE TWITTER EST UNE OPERATION PSYCHOLOGIQUE DE QUALITE MILITAIRE
- SHINZO ABE S'EST OPPOSE AUX VACCINS COVID ET A PROMU L'IVERMECTINE
- JUSTIN BIEBER PARALYSE PAR LE SYNDROME DE RAMSAY HUNT
- HOMOSEXUELS AYANT PLUSIEURS PARTENAIRES SONT LA PRIORITE ABSOLUE DE LA CAMPAGNE DE VACCINATION CONTRE LA VARIOLE DU SINGE
- LE SYSTEME BANCAIRE CHINOIS MANQUE DE LIQUIDITES
- ZUCKERBERG AVERTIT QUE LES VACCINS COVID-19 SONT "EXPERIMENTAUX" ET "NON PROUVES"
- MAGNESIUM : UN MINERAL ESSENTIEL DONT VOTRE CORPS A BESOIN POUR UNE SANTE OPTIMALE
- L'IMMUNITE NATURELLE CONTRE LE COVID NE DECLINE JAMAIS
- UN GROUPE INTERNATIONAL FINANCE PAR BILL GATES PREVIENT QUE L'UN DES 11 NOUVEAUX VIRUS DEVIENDRA LA "PROCHAINE PANDEMIE"
- LES 7 PRINCIPALES FAÇONS DONT LES « MOUTONS » AMERICAINS ONT ETE MANIPULES
- LA QUERCETINE PEUT VOUS PROTEGER DES EFFETS NOCIFS DES PESTICIDES
- CE QUE VOUS DEVEZ SAVOIR SUR LES CHEVEUX BLANCS
- LA MASTURBATION PEUT-ELLE CAUSER LA CHUTE DES CHEVEUX
- LES DONNEES CANADIENNES MONTRENT QUE LES « VACCINS » COVID AUGMENTENT LE RISQUE DE DECES PAR COVID
- UN JEUNE HOMME DU COLORADO A PRIS A CONTRECŒUR UN VACCIN COVID
- POURRIEZ-VOUS AVOIR UNE CRISE CARDIAQUE SANS LE SAVOIR ?
- PRESQUE TOUS LES SITES WEB D'INFORMATION COVID DU GOUVERNEMENT SONT DES OPERATIONS SECRETES D'ESPIONNAGE
- LE MILLIARDAIRE ELON MUSK SUSPEND SON ACHAT DE TWITTER
- LES RESPONSABLES BRITANNIQUES ONT DISCRETEMENT PUBLIE DES DONNEES
- L'ERE OBAMA ET LES MANDATS DE VACCINS A BLAMER POUR LA PENURIE DE PILOTES
- LES BAS DE COMPRESSION AIDENT-ILS A TRAITER LES VARICES
- LA PERCEE COMMERCIALE DE LA FUSION A FROID (LENR) POURRAIT METTRE FIN A LA PENURIE DE NOURRITURE
- L'ALLEMAGNE NE SURVIVRA PAS A L'HIVER SANS GAZ RUSSE – OFFICIEL
- VIROLOGY JOURNAL CONFIRME QUE LES PIQURES DE COVID EPUISENT LA FONCTION IMMUNITAIRE
- LES BIOSTRUCTURES DE CAILLOTS DE VACCIN A AUTO-ASSEMBLAGE RECOLTENT LES METAUX CONDUCTEURS DE VOTRE SANG
- DES MILLIERS DE PERSONNES MEURENT "DE FAÇON INATTENDUE" CHAQUE SEMAINE DANS L'ERE POST-COVID
- UN NOMBRE ÉLEVÉ DE PARTICIPANTS AUX ESSAIS CLINIQUES DE VACCINS SE RETIRENT
- VACCIN MODERNA :BENEFICES DE LA PANDEMIE
- LES HUIT MEILLEURS ALIMENTS POUR VOTRE SANTE CARDIAQUE
- BOIRE DU JUS DE BETTERAVE TOUS LES JOURS REDUIT L'HYPERTENSION ARTERIELLE
- LE RAPPORT DE SURVEILLANCE DE NSW CONFIRME QUE LES PERSONNES PIQUEES SONT PLUS SUSCEPTIBLES D'ETRE HOSPITALISEES AVEC COVID
- LE CORONAVIRUS LE PLUS INFECTIEUX A CE JOUR, CONTOURNE LES ANTICORPS
- LA POPULATION VACCINEE REPRESENTE 92 % DES DECES DUS A LA COVID-19 AU CANADA
- MONKEYPOX EST PRINCIPALEMENT TRANSMIS SEXUELLEMENT PAR LES HOMMES
- VOUS POUVEZ PRENDRE L'ADN DE QUELQU'UN ET CONCEVOIR UNE ARME QUI PEUT LE TUER
- TOUTE PERSONNE QUI REÇOIT LE VACCIN CONTRE LA VARIOLE DU SINGE FAIT PARTIE D'UN « ESSAI CLINIQUE »
- LES CODES QR COVID SONT DESORMAIS UTILISES POUR RATION FUEL AU SRI LANKA ALORS QUE L'EFFONDREMENT ECONOMIQUE S'ACCELERE
- UN MEMBRE DU COMITE DU RENSEIGNEMENT MET EN GARDE CONTRE UNE MENACE POSSIBLE CIBLANT L'ADN DES AMERICAINS
- OU EST LE BOEUF? DEMANDEZ A BILL GATES
- LA PESTE NOIRE ET LE VIRUS INCURABLE DE MARBURG SE PROPAGENT DESORMAIS DANS LES VILLES AFRICAINE
- UNE CATASTROPHE SE PROFILE ALORS QUE LE VIRUS DE MARBURG A PEUT-ETRE ETE LIBERE VIA DES CHARGES UTILES DE VACCINS COVID-19
- LES PERSONNES VACCINEES «INFECTENT» LES NON VACCINES AVEC DE L'OXYDE DE GRAPHENE DANGEREUX
- LA VACCINATION EQUIVAUT A UNE CONDAMNATION A MORT VOLONTAIRE
- SE FAIRE "VACCINER" CONTRE LA VARIOLE DU SINGE VOUS INSCRIT AUTOMATIQUEMENT DANS "L'ESSAI CLINIQUE"
- HAUT DIRIGEANT DE L'UE: LES VACCINS COVID SONT «LE PLUS GRAND CRIME JAMAIS COMMIS CONTRE L'HUMANITE»
- VARIOLE DU SINGE REVELE QUE PRESQUE TOUS LES CAS IMPLIQUENT DES RAPPORTS SEXUELS ENTRE HOMMES HOMOSEXUELS
- LES KITS DE TEST ADN SONT UNE ARNAQUE POUR DEVELOPPER DES ARMES BIOLOGIQUES SPECIFIQUES A UNE ETHNIE
- LES NANOPARTICULES D'OR PEUVENT ETRE UTILISEES POUR TUER LES CELLULES TUMORALES
- VACCIN COVID ? LES CYCLISTES DU TOUR DE FRANCE "SOUFFRENT DE PROBLEMES RESPIRATOIRES"
- LA GRANDE MAJORITE DE LA PHARMACOLOGIE, DE LA SCIENCE DES VACCINS EST UNE FRAUDE COMPLETE
- MCDONALD'S MET FIN AUX TESTS DE MCPLANT BURGER
- DARPA, LES INSECTES, LA SCIENCE FOLLE ET NOUS : NULLE PART OU SE CACHER
- DONNEES VAERS : PLUS DE PERSONNES ONT SUBI DES LESIONS CEREBRALES A CAUSE DES VACCINS COVID
- LE GOUVERNEMENT AMERICAIN ET LE CDC ONT COLLABORE AVEC GOOGLE, TWITTER ET FACEBOOK
- LE BRAS D'UN NOUVEAU-NE AMPUTÉ APRES QUE MAMAN AIT PRIS DES VACCINS COVID
- LES PLATEFORMES SOCIALES CHINOISES SE PRECIPITENT POUR CENSURER LES MANIFESTATIONS HYPOTHECAIRES
- ALIMENTS , HERBES,NUTRIMENTS CURATIFS POUR LES CAILLOTS SANGUINS
- LES PRODUITS PHARMACEUTIQUES PEUVENT AMENER LES ENFANTS A DEVENIR AVEUGLE
- LE COMPOSE DE BROCOLI PEUT RESOUDRE LE PROBLEME DE LA RESISTANCE AUX ANTIBIOTIQUES
- LES DECES DE «COVID» ATTEIGNENT UN NOUVEAU RECORD DANS UNE AUSTRALIE HYPER-VACCINEE
- UN FOOTBALLEUR CHRETIEN CHOISIT DE NE PAS PARTICIPER AU MATCH PLUTOT QUE DE PORTER LE MAILLOT LGBT PRIDE
- LES 5 REMEDES ALTERNATIFS LES PLUS EFFICACES
- COMMENT UNE INFIRMIERE COURAGEUSE A REVELE LES MUTILATIONS SEXUELLES D'ENFANTS QUI ONT LIEU A TAVISTOCK
- LES RECLAMATIONS D'ASSURANCE-VIE MONTENT EN FLECHE APRES LE DEPLOIEMENT DU VACCIN COVID
- DÉCOUVERTE DE CHOC : CHAQUE FOIS QU'UNE FEMME A DES RELATIONS SEXUELLES AVEC UN HOMME, ELLE CONSERVE SON ADN DANS SON CERVEAU
- LES VACCINS COVID PROVOQUENT DEJA UN DEPEUPLEMENT MASSIF
- 1 SUR 6 “COMPLETEMENT VACCINES” POUR COVID ADULTES AMERICAINS MAINTENANT SOUFFRE DE GRAVES PROBLEMES DE SANTE
- LA VITAMINE D POURRAIT AVOIR FACILEMENT ARRETE COVID DE SE PROPAGER, REVELE MEDECIN
- UNE PERSONNE SUR 800 DE PLUS DE 60 ANS QUI SE FAIT VACCINER CONTRE LE COVID MEURT
- LE BUSINESS DE LA MORT EN PLEIN ESSOR GRACE AUX VACCINS COVID
- LES DONNEES GOUVERNEMENTALES MONTRENT QUE 1 PERSONNE VACCINEE CONTRE LE COVID SUR 246 MEURT DANS LES 60 JOURS
- LE CDC RECONNAIT ENFIN LE DROIT DES "INDIVIDUS" A FAIRE LEURS PROPRES CHOIX DE SANTE
- ENVIRON 30% DES JEUNES QUI SE FONT PIQUER POUR COVID SOUFFRENT DE LESIONS CARDIAQUES,
- L'ACUPUNCTURE BAT LA MORPHINE INJECTEE CONTRE LA DOULEUR
- COMMENT UNE INFIRMIERE COURAGEUSE A REVELE LES MUTILATIONS SEXUELLES D'ENFANTS QUI ONT LIEU A TAVISTOCK
- VACCINS RESTREINT LES LIBERTES EN FONCTION DES NIVEAUX DE CODE COULEUR ET DU STATUT DE RAPPEL DU VACCIN
- LE CDC PLAIDE L'IGNORANCE DU LIEN ENTRE LES PIQURES COVID ET L'INFLAMMATION CARDIAQUE
- ISRAËL VEUT ARRÊTER LE VACCIN CONTRE LA RAGE POUR LES ANIMAUX
- UNE DROGUE COURAMMENT PRESCRITE PAR LES MEDECINS QUI REÇOIVENT DE SOMPTUEUSES PRIMES POUR L'AVOIR
- LES 8 PRINCIPALES CAUSES DE CANCER QUE VOUS NE CONNAISSEZ PROBABLEMENT PAS ENCORE
- DES ESSAIS CLINIQUES POUR L'ARNM FLU SHOTS DEJA EN COURS
- DES CENTAINES DE MILLIERS DE PERSONNES SERAIENT MORTES CHAQUE SEMAINE DES INJECTIONS COVID DE PFIZER
- DES BÉBÉS DE RATS DE LABORATOIRE VACCINÉS CONTRE LE COVID SOUFFRENT DE MALFORMATIONS DES CÔTES
- MONKEYPOX EST UNE MALADIE HOMOSEXUELLE TRANSMISE PAR LE LIQUIDE SÉMINAL
- ALBERT BOURLA, AFFIRME QU'IL A "COVID" APRÈS AVOIR PRIS QUATRE DOSES DE VACCIN À ARNM
- RAPPORT MÉDICAL POPULAIRE SUR LA PROGRESSION RAPIDE DE LA MALADIE DE CREUTZFELDT-JAKOB
- LE GRAPHÈNE PEUT ÊTRE UTILISÉ POUR ASSEMBLER L'ÉLECTRONIQUE RADIOFRÉQUENCE DANS LES SYSTÈMES BIOLOGIQUES
- DES « VACCINS » AÉROSOLS EN COURS DE DÉVELOPPEMENT QUI PEUVENT ÊTRE PULVÉRISÉS SUR LES VILLES HUMAINES
- LES DÉCÈS DUS À DES «CAUSES MAL DÉFINIES ET INCONNUES» (ALIAS VACCINS COVID) MONTENT EN FLÈCHE
- TOUS LES VACCINS COVID « SANS EXCEPTION » CONTIENNENT DE MYSTÉRIEUSES TOXINES MÉTALLIQUES
- UN DÉNONCIATEUR RÉVÈLE QUE LES BOTS CONSTITUENT LA MAJORITÉ DES UTILISATEURS DE TWITTER
- LES DERNIÈRES DONNÉES ACTUARIELLES RELIENT LES DÉCÈS EXCESSIFS AUX MANDATS DE VACCINATION CONTRE LES COVID
- LES HACKS DE FOX NEWS PRÉTENDANT SOUDAINEMENT QU'ILS N'ONT PAS POUSSÉ LES VACCINS COVID SUR LES TÉLÉSPECTATEURS
- LE SANG VACCINÉ EST DU SANG CONTAMINÉ
- ATTENDEZ-VOUS À ENDURER DES HIVERS RIGOUREUX PENDANT DES ANNÉES À VENIR
- 91% DES ELECTEURS DE BIDEN ONT PRIS LE VACCIN
- 91% DES ELECTEURS DE BIDEN ONT PRIS LE VACCIN
- 94 % DES RECEVEURS D'ARNM ONT TROUVE DES "OBJETS RESSEMBLANT A DU METAL" DANS LEUR SANG
- 91% DES ELECTEURS DE BIDEN ONT PRIS LE VACCIN, PROUVANT QUE STUPIDE EN POLITIQUE SIGNIFIE STUPIDE EN SANTE
- 91% DES ELECTEURS DE BIDEN ONT PRIS LE VACCIN, PROUVANT QUE STUPIDE EN POLITIQUE SIGNIFIE STUPIDE EN SANTE
- LA PENURIE DE GAZ NATUREL S'AGGRAVE EN EUROPE ET DECLENCHERA UNE CRISE ALIMENTAIRE DANS LES MOIS A VENIR
- LE MINISTRE ISRAELIEN DE LA SANTE A COMPLOTE POUR MANIPULER LE RAPPORT D'EXPERT SUR LE VACCIN COVID AFIN D'EVITER UN LITIGE
- APRES L'HOLOCAUSTE DU VACCIN COVID-19, IL EST TEMPS DE SÉCURISER NOS ENFANTS CONTRE LE TERRORISME DES BIG PHARMA
- LES VACCINATIONS COVID DESORMAIS INTERDITES CHEZ LES MOINS DE 50 ANS AU DANEMARK
- BILL GATES SE VANTE D'AVOIR ORDONNE A TRUMP DE NE PAS ENQUETER SUR LES DANGERS
- LA CROIX-ROUGE AMERICAINE SURPRISE EN TRAIN DE MELANGER DU SANG DES VACCINES AVEC DU SANG DE NON VACCINES
- CONFIRMÉ : LES PIPELINES NORD STREAM 1 ET 2 SABOTÉS ALORS QUE LA TROISIEME GUERRE MONDIALE SE PROFILE
- LE MEDICAMENT ANTIPARASITAIRE FENBENDAZOLE ARRETE LA CROISSANCE DES TUMEURS CANCEREUSES CHEZ LA SOURIS
- LES MOUSTIQUES OGM VACCINENT MAINTENANT SECRETEMENT LES GENS SANS LEUR CONSENTEMENT
- LE CHEF DE L'ALIMENTATION DE L'ONU DECRIT LA "DESTABILISATION DES NATIONS" RESULTANT DE LA FAMINE
- LES NIVEAUX DE DIOXYDE DE CARBONE N'ONT RIEN A VOIR AVEC LES TEMPERATURES MONDIALES
- AVOIR DES RELATIONS SEXUELLES AU MOINS DEUX FOIS PAR SEMAINE MAINTIENDRAIT EN BONNE SANTE
- AVOIR DES RELATIONS SEXUELLES AU MOINS DEUX FOIS PAR SEMAINE MAINTIENDRAIT EN BONNE SANTE
- L'ADMINISTRATEUR DE BIDEN ADMET ESSENTIELLEMENT AVOIR SABOTE LE PIPELINE RUSSE
- LES MEDECINS HOSPITALIERS BRITANNIQUES DEMISSIONNENT EN NOMBRE CHOQUANT
- L'ACHAT EXCESSIF DE PIQURES COVID PAR L'UE EQUIVAUT AU "PLUS GRAND SCANDALE DE CORRUPTION DE L'HISTOIRE DE L'HUMANITE"
- PAYPAL N'A PAS ANNULE SA POLITIQUE DE PILLAGE DES COMPTES
- LE NOUVEAU MEDICAMENT ANTIVIRAL PAXLOVID DE PFIZER EST UNE IMITATION DANGEREUSE DE L'IVERMECTINE
- UN GENERAL FRANÇAIS DIT QUE LES CITOYENS NON VACCINES SONT DES "SUPER-HEROS" QUI "INCARNENT LE MEILLEUR DE L'HUMANITE"
- UN SURVIVANT D'UN CAMP DE CONCENTRATION ARRÊTÉ PAR LE FBI POUR AVOIR MANIFESTE PACIFIQUEMENT CONTRE LE MEURTRE D'UN BEBE
- LA POLOGNE SE SORT DE LA CRISE ENERGETIQUE AVEC LE CHARBON
- DOUG BRIGNOLE DECEDE DE "CAUSES INCONNUES" APRES AVOIR REÇU UN VACCIN MODERNA
- LE CARDIOLOGUE DIT QUE TOUS LES VACCINS COVID DOIVENT ETRE SUSPENDUS IMMÉDIATEMENT
- DES AVOCATS PRETS A POURSUIVRE EN JUSTICE TOUT ÉTAT QUI TENTE DE FORCER LES ECOLIERS A SE « VACCINER » CONTRE LE COVID
- PFIZER ADMET PAR CONTRAT QUE LES EFFETS A LONG TERME ET L'EFFICACITE DU VACCIN COVID-19 "NE SONT PAS ACTUELLEMENT CONNUS"
- EFFET INDESIRABLE DU MANDAT DU VACCIN : L'ARMEE EST EN DEÇA DE 25 % DE L'OBJECTIF DE RECRUTEMENT DE 2022
- UN EXPERT EN VACCINS AFFIRME QUE « LES VACCINES » SONT RESPONSABLES DE LA « FIN IMMINENTE DE LA CIVILISATION OCCIDENTALE »
- DJ REND PUBLIC LES HORREURS DES DOMMAGES CAUSES PAR LE VACCIN COVID… DES JOURS ATROCES DE DOULEUR ET DE SOUFFRANCE
- AMERICAINS ILLEGALEMENT CIBLES AVEC DES SCORES SECRETS DE «VIOLATION DU DECRET COVID»
- YOUTUBE ANNONCE UN NOUVEAU PROTOCOLE DE "CERTIFICATION" POUR LES VIDEOS CONTENANT DES INFORMATIONS MEDICALES
- APPROVISIONNEMENT ALIMENTAIRE 101 : CONSEILS POUR PREPARER UN STOCK D'ALIMENTS SAINS
- LES PERSONNES VACCINEES PEUVENT TOUJOURS ATTRAPER LE COVID-19
- LE TAUX DE MORTALITE EST EN HAUSSE DE 17% DANS LE MONDE VACCINE
- LE BRAS DROIT DE KLAUS SCHWAB APPELLE A UN "EVENEMENT D'EXTINCTION DE MASSE" POUR INAUGURER LA GRANDE REINITIALISATION
- L'ALLEMAGNE DEMANTELE UN PARC EOLIEN POUR FAIRE PLACE A UNE MINE DE CHARBON
- LE «LEADER MONDIAL DE L'EUTHANASIE» ENVISAGE MAINTENANT LE SUICIDE
- DES DIZAINES DE PEPTIDES DE VENIN DANS LE PLASMA SANGUIN ET LES ECHANTILLONS FECAUX DE PATIENTS ATTEINTS DE COVID-19
- LA RUSSIE IDENTIFIE DES VEHICULES AERIENS SANS PILOTE AU-DESSUS DE LA VILLE PORTUAIRE UKRAINIENNE DE KHERSON
- DES CENTAINES D'ACCIDENTS SE SONT PRODUITS DANS DES BIOLABS AMERICAINS MAIS N'ONT JAMAIS ETE SIGNALES
- UN SCIENTIFIQUE AMERICAIN DENONCE LES CHERCHEURS DE L'UNIVERSITE FINANCEE PAR BILL GATES
- CVS, WALMART ET WALGREENS PAIERONT 13,8 MILLIARDS DE DOLLARS POUR RESOUDRE LES POURSUITES POUR OPIOÏDES
- LE PROJET DE LOI C-11 DE JUSTIN TRUDEAU VISE A CONTRÔLER CE QUE LES CANADIENS PEUVENT REGARDER EN LIGNE
- UNE ENTREPRISE UKRAINIENNE DEMANDE AU FABRICANT DE DRONES TURC
- LA RUSSIE PRESENTERA DES "PREUVES" QUE LES FORCES SPECIALES BRITANNIQUES ETAIENT A L'ORIGINE DES ATTAQUES EN CRIMEE
- HOLOCAUSTE DES ENFANTS A NAITRE : DES BEBES MEURENT PARCE QUE LEURS MERES ONT ETE « VACCINEES » CONTRE LE COVID
- TOP 7 DES "PRODUITS" ET "SYSTEMES" ARTIFICIELS QUI PEUVENT RACCOURCIR CONSIDERABLEMENT VOTRE ESPERANCE DE VIE
- UN VACCIN CONTRE LA MALADIE DE LYME, ET IL A ETE RETIRE DU MARCHE EN RAISON DE « MAUVAISES VENTES »
- HAUSSE RECORD DES INFECTIONS RESPIRATOIRES CHEZ LES ENFANTS
- DES CAILLOTS MYSTERIEUX QUI TUENT DES GENS CAUSES PAR DES PROTEINES DE POINTE DES VACCINS COVID
- UN BREVET AMERICAIN DECRIT UN PROGRAMME DE CHEMTRAILS « AERIENS DE MOUSTIQUES TOXIQUES »
- LES SYNDICATS MEDICAUX EN AUSTRALIE REPOUSSENT L'AMENDEMENT QUI VISE A PUNIR LES MEDECINS
- 7 AVANTAGES SCIENTIFIQUES POUR LA SANTE DE MANGER DES ALIMENTS RICHES EN ACIDES GRAS OMEGA-3
- LE CHANGEMENT CLIMATIQUE EST UN MYTHE MALVEILLANT ET DANGEREUX
- UNE ADOLESCENTE EN BONNE SANTE MEURT DANS SON SOMMEIL APRES AVOIR REÇU UNE INJECTION DE RAPPEL COVID-19
- EST-IL POSSIBLE D'EVITER LES DOMMAGES CARDIAQUES CAUSES PAR LE VACCIN COVID
- VOS MUSCLES RENFORCENT VOTRE CŒUR
- RISQUE DE CAILLOT SANGUIN : CE COMPOSE UNIQUE DANS L'EXTRAIT DE PEPINS DE RAISIN AIDE A PROTEGER VOTRE CIRCULATION
- RALENTISSEZ VOTRE CŒUR QUI BAT - HARICOTS VS EXERCICE
- MARCHER 10 000 PAS C'EST BIEN, MARCHER VITE C'EST BIEN
- LES HOMMES CHAUVES PEUVENT AVOIR UN RISQUE PLUS ELEVE DE MALADIE CARDIAQUE
- MYOCARDITE INDUITE PAR LE VACCIN COVID-19 – UNE CAUSE DE DECES PROUVEE ?
- CET INGREDIENT DE TOUS LES JOURS AUGMENTE LE RISQUE DE CANCER ET DE MALADIE CARDIAQUE - VOICI COMMENT L'EVITER
- 1 PATIENT SUR 8 SOUFFRE D'UN LONG COVID
- SIGNES QUE VOUS AVEZ UN CAILLOT SANGUIN DE PROTEINE DE POINTE ET QUE FAIRE A CE SUJET
- EXCRETION DU VACCIN COVID—CANARIS DANS LA MINE
- LES PROTEINES DE POINTE SE DEPOSENT DANS LE CORPS APRES COVID OU VACCIN
- UN EXPERT EXPLIQUE QUE LE CANCER PEUT ETRE UNE MALADIE METABOLIQUE ET PARTAGE UN REMEDE
- LA PROTECTION CONTRE LA 4E DOSE DE VACCIN COVID DIMINUE COMPLETEMENT EN QUELQUES MOIS
- AFFAMER NATURELLEMENT LES CELLULES CANCEREUSES AVEC CES ALIMENTS
- UNE PERSONNE SUR 310 AYANT REÇU UN RAPPEL EST DECEDEE DANS LES 48 JOURS SUIVANT LA VACCINATION
- À FAIRE ET A NE PAS FAIRE EN CAS DE RHUME OU DE GRIPPE
- PRENEZ LA VOIE CONSCIENTE POUR ABAISSER LA TENSION ARTERIELLE
- MANGER TARD DANS LA NUIT EST PLUS SUSCEPTIBLE DE CONDUIRE AU DIABETE ET AUX TROUBLES METABOLIQUES
- PFIZER PREVOIT D'AUGMENTER LE PRIX DES VACCINS COVID DE 10 000 %
- TWITTER NETTOIE DES IMAGES MONTRANT L'EFFONDREMENT D'UN AVOCAT DE LA LOI SUR LES URGENCES APRES AVOIR PRIS UN VACCIN COVID
- LE DR SHERRI TENPENNY MET EN GARDE CONTRE LE TSUNAMI DE MORT CAUSE PAR LES VACCINS COVID-19
- IMMUNOLOGUE DR JENNA MACCIOCHI : LE SYSTEME IMMUNITAIRE EST VOTRE PLUS GRAND ATOUT POUR LA SANTE
- UNE NOUVELLE TECHNOLOGIE D'IA DETECTE LES MUTATIONS DU CANCER EN QUELQUES MINUTES
- CANCER OU COVID – TOUT PEUT ETRE TRAITE AVEC LA MEDECINE TRADITIONNELLE CHINOISE
- GÉNOCIDE AU RALENTI : SURMORTALITE EN HAUSSE DE 40 % DANS LE MONDE ENTIER SUITE A LA PUBLICATION DE "VACCINS" COVID
- ÉTUDE : LE TRAITEMENT DES TROUBLES SANGUINS PEUT ACTIVER LE GENE CANCERIGENE CHEZ CERTAINS PATIENTS
- LES CINQ MEILLEURS AGENTS ANTIVIRAUX NATURELS
- PLUS D'AVANTAGES POUR LA SANTE DE LA QUERCETINE REVELES
- UN SCIENTIFIQUE INTERPELLE LE GOUVERNEMENT POLONAIS POUR AVOIR TENTE DE LÉGALISER LE GÉNOCIDE
- LA GRANDE MAJORITE DES DECES DE COVID SE PRODUISENT MAINTENANT DANS LE PAYS ENTIEREMENT PIQUE
- LE TRANSGENRE ENRACINE DANS UNE FRAUDE SCIENTIFIQUE MASSIVE, SELON UN PSYCHIATRE
- MEDECINE DE SURVIE : 14 ALTERNATIVES NATURELLES AUX ANTIBIOTIQUES
- DES DIZAINES DE GROUPES DE SOUVERAINETE ALIMENTAIRE SIGNENT UNE LETTRE OUVERTE CONDAMNANT BILL GATES
- LA FDA AFFIRME MAINTENANT QUE SA CROISADE CONTRE L'IVERMECTINE N'ETAIT QU'UNE "RECOMMANDATION" CONTRE SA PRISE
- LA VITAMINE D A 50 000 UI PAR JOUR AURAIT PU SAUVER 116 000 VIES AMERICAINES PERDUES PENDANT LE COVID
- LA POLICE ESPAGNOLE UTILISERA BIENTOT LA TECHNOLOGIE DE RECONNAISSANCE FACIALE AUTOMATISEE
- 12 FAÇONS NATURELLES DE SE DEBARRASSER EFFICACEMENT DES MAUX DE TETE
- ALIMENTS CURATIFS POUR LES ACOUPHENES
- LA FAA MET EN GARDE CONTRE LE DEPLOIEMENT DE LA 5G
- 7 REMEDES NATURELS POUR SOULAGER LA CONGESTION
- LES NEW-YORKAIS DESEMPARES VEULENT QUE DES MILLIERS DE TOURS 5G DANS LA VILLE DISPARAISSENT
- KROGER CONDAMNE A PAYER 180 000 $ A DEUX EMPLOYES QUI ONT ETE LICENCIES
- LES MEDECINS AVERTISSENT QUE NOUS SOMMES SUR LE POINT DE VOIR L'UNE DES PLUS GRANDES MORTS DE TOUS LES TEMPS
- ALIMENTS CURATIFS POUR LES CAILLOTS SANGUINS
- SIGNES AVANT-COUREURS DE LA DEMENCE
- UN FACTEUR DE RISQUE SURPRENANT DE MALADIE CORONARIENNE
- TOP 10 DES ADDICTIONS ET LES STATISTIQUES ALARMANTES POUR LES USA
- L'APOCALYPSE DES PROTEINES DE POINTE A-T-ELLE COMMENCE ?
- DES DONNEES CHOQUANTES MONTRENT UNE AUGMENTATION DE 4 800 % DES DECES PAR VAX
- CHANGER SIMPLEMENT VOTRE REGIME ALIMENTAIRE PEUT REDUIRE LES TUMEURS DU CANCER DU COLON
- LES INJECTIONS D'ARNM COVID PROVOQUANT CHEZ CERTAINS RECEVEURS DES CHANGEMENTS DRASTIQUES DE PERSONNALITE
- LES EXERCICES D'ELEVATION DES JAMBES PEUVENT AMELIORER LA CIRCULATION MICROVASCULAIRE CARDIAQUE
- L'IVERMECTINE FONCTIONNE, MEME SI L'ETABLISSEMENT PRETEND FAUSSEMENT LE CONTRAIRE
- LE SYNDROME DE LA PERSONNE RAIDE DE CELINE DION EST PRESQUE CERTAINEMENT CAUSE PAR LE VACCIN COVID-19
- LA VAXICARDITE, LES VACCIDENTS ET LA VACCIMENTIA AUGMENTERONT TOUS GRACE AUX «BOOSTERS» DE PROTEINES DE POINTE
- LEANA WEN CHANGE DE TON DIT MAINTENANT QUE LES VACCINS COVID SONT DANGEREUX ET NE DEVRAIENT PAS ETRE OBLIGATOIRES
- 4 RAISONS DE PRENDRE DE LA VITAMINE B3 TOUS LES JOURS
- PRODUITS POUR ELIMINER L'OXYDE DE GRAPHENE
- DES CHERCHEURS CHINOIS CELEBRENT UNE ETUDE UTILISANT DES MOUSTIQUES POUR ADMINISTRER DES «VACCINS»
- NETANYAHU ADMET QUE LE GOUVERNEMENT ISRAELIEN S'EST ASSOCIE A PFIZER
- SE FAIRE VACCINER CONTRE LE COVID QUATRE FOIS OU PLUS ENTRAINE UN EFFONDREMENT PRESQUE COMPLET DU SYSTEME IMMUNITAIRE
- LA LEGISLATURE DE FLORIDE INTERDISE DEFINITIVEMENT LES MANDATS DE MASQUE ET DE VACCIN COVID-19
- LA DERNIERE VARIANTE D'OMICRON EST PLUS SUSCEPTIBLE D'INFECTER LES VACCINÉS, ADMET LE CDC
- LES ATHLETES TOMBENT COMME DES MOUCHES A CAUSE DE CRISES CARDIAQUES
- LA VERITABLE HISTOIRE DE LA CONDUITE CRIMINELLE ET DU MEURTRE PHARMACEUTIQUE DE PFIZER
- LES VACCINS COVID ONT ETE CONÇUES POUR CAUSER DES DOMMAGES
- LA CHINE REMPLACE SES AVOIRS DU TRESOR AMERICAIN PAR DE L'OR
- PLUS UN BEBE REÇOIT DE VACCINS, PLUS LE RISQUE DE MORT SUBITE EST ELEVE
- LES ACTIONS DE GOOGLE PERDENT 100 MILLIARDS DE DOLLARS
- COMMENT WASHINGTON ECHOUE A BALAYER LA REVELATION DU BIOLAB UKRAINIEN SOUS LE TAPIS
- JAUNES D'OEUFS ATTENUENT NATURELLEMENT LES PROTEINES DE POINTE DU "VACCIN" COVID
- LE GOUVERNEMENT RUSSE EXIGE QUE LES PARTIES RESPONSABLES AUX ÉTATS-UNIS SOIENT TENUES RESPONSABLES
- PLUS DE 60 SCIENTIFIQUES APPELLENT A LA FIN DES «VACCINS» CONTRE LE COVID-19
- DES MILLIONS DANS LE MONDE SOUFFRENT DESORMAIS DE GRAVES PROBLEMES DE SANTE CAUSES PAR LES «VACCINS»
- DES E-MAILS DETERRES DE 2020 PROUVENT QUE LE TEST PCR COVID EST UNE ARNAQUE
- DES METAUX COMME LE CUIVRE ET L'OR PEUVENT AIDER A METTRE FIN A LA PANDEMIE DE COVID-19, SELON DES CHERCHEURS
- LES ENFANTS QUI ATTRAPENT UN RHUME SANS VACCINS DEVELOPPENT UNE IMMUNITE NATURELLE
- L'ETABLISSEMENT MEDICAL DIABOLISE L'AMYGDALINE, UN TRAITEMENT NATUREL EFFICACE CONTRE LE CANCER
- VOUS VOUS SOUVENEZ QUAND TRUMP A FAIT TAPIS POUR LES OGM ?
- LE MINISTRE ALLEMAND DE LA SANTE ADMET QUE LES VACCINS COVID-19 SONT NOCIFS APRES
- DES DIZAINES DE MILLIERS DE PERSONNES ONT ETE TUEES PENDANT LA «PANDEMIE» EN LES METTANT SOUS RESPIRATEUR
- IL EST TEMPS DE PARLER DES LIENS DE SVB AVEC LE FORUM ECONOMIQUE MONDIAL
- L'ANCIEN DIRECTEUR DU CDC PREVIENT QU'UNE "GRANDE PANDEMIE ARRIVE"
- JPMORGAN CHASE POUR DES ALLEGATIONS DE TRAFIC SEXUEL AVEC JEFFREY EPSTEIN
- LES JEUNES ATHLETES MASCULINS DEVELOPPENT MAINTENANT UN CANCER DES TESTICULES "TURBO" - LES "VACCINS" COVID SONT-ILS A BLAMER ?
- LA PROCHAINE « PANDEMIE » EST DEJA PREVUE : SRAS + VIH + H5N1 (GRIPPE AVIAIRE)
- DR MALONE : DES VACCINS A ARNM SONT INJECTES DANS NOTRE APPROVISIONNEMENT ALIMENTAIRE
- BUVEZ LE VACCIN : LA CHINE « IMMUNISE » DES SOURIS AVEC DU LAIT DE VACHE INFUSE D'ARNM
- LES VACCINS A ARN PEUVENT ETRE ABSORBES PAR L'ESTOMAC ET LES INTESTINS
- LA "LOI ANTI-INSECTES" DE LA POLOGNE : LA BATAILLE CONTRE L'AGENDA MONDIALISTE VISANT A REMPLACER LA VIANDE PAR DES INSECTES
- DES SAVANTS FOUS EXPERIMENTENT MAINTENANT DES INJECTIONS D'ARNM DANS LE BŒUF
- MAGNESIUM : UN NUTRIMENT SOUS-ESTIME POUR LA SANTE DU CERVEAU ET LE BIEN-ETRE MENTAL
- LA FDA MET FIN AU PROTOCOLE OFFICIEL DE "VACCIN" COVID, QUE LES GENS NE DEVRAIENT PAS RECEVOIR PLUS D'UNE DOSE D'ARNM
- LA CHINE PUBLIE DE NOUVEAUX DETAILS SUR LES SANCTIONS CONTRE RAYTHEON ET LOCKHEED
- LES 7 PRINCIPAUX TYPES DE CAS DE CANCER MONTENT EN FLECHE DEPUIS QUE LES HUMAINS ONT COMMENCE A RECEVOIR DES INJECTIONS COVID
- LE REGIME DE BIDEN EMPRISONNE QUATRE AMERICAINS POUR AVOIR DIT DES CHOSES QUE L'ADMINISTRATION N'AIME PAS
- LA CHEF DU CDC ADMET ENFIN QU'UNE PIQURE COMPLETE PEUT ENCORE PROPAGER LE COVID
- UN INITIE DE L'OMS DENONCE GAVI ET BILL GATES POUR AVOIR PERPETRE LA PANDEMIE DE CORONAVIRUS
- LES MALADIES A BASE DE PRIONS PEUVENT ETRE INDUITES PAR DES VACCINS A ARNM
- LES VACCINS A ARN NE CONTIENNENT PAS STRICTEMENT D'ARNM, ILS CONTIENNENT DU MODARN
- UN GROUPE BOVIN FORME UN GROUPE DE TRAVAIL SPECIAL POUR ENVISAGER LA «VACCINATION» PAR ARNM
- MEFIEZ-VOUS DES GUICHETS AUTOMATIQUES INVERSES QUI PRENNENT VOTRE ARGENT
- LA FDA AFFIRME QUE LES NOUVEAUX VACCINS N'ONT PLUS A PREVENIR L'INFECTION OU LA TRANSMISSION POUR ETRE APPROUVES
- BIG PHARMA VEUT QUE LES ANIMAUX D'ELEVAGE REÇOIVENT UNE INJECTION D'ARNM
- LE COVID ET LES « VACCINS » SONT-ILS LA PIRE ATROCITE GENOCIDAIRE DE L'HISTOIRE MONDIALE
- LES HOPITAUX SONT DEVENUS DES CAMPS D'INSTALLATIONS DE MORT ET DE MEURTRE PENDANT LE COVID
- LES RECOMMANDATIONS RELATIVES AUX MASQUES FACIAUX DANS LES ECOLES N'ONT PAS EU D'IMPACT SUR L'INCIDENCE DU COVID-19
- COMMENT SUPPRIMER L'OXYDE DE GRAPHENE DU CORPS
- DES VACCINS A ARNM SONT INJECTES DANS NOTRE APPROVISIONNEMENT ALIMENTAIRE
- UN LABORATOIRE BIOLOGIQUE STOCKANT DES VACCINS CONTRE LA ROUGEOLE ET LE CHOLERA
- TOP 5 DES VERITES SUR LES "VACCINS" COVID QUE PHARMA NE MENTIONNE JAMAIS JUSQU'A CE QU'ILS SOIENT OBLIGES DE LE FAIRE
- LES PLANTES CONTRE LE CANCER : DIX-HUIT PHYTOCHIMIQUES 100% NATURELS QUI PREVIENNENT ET SOIGNENT LES CANCERS
- LE RAYONNEMENT RF DES TELEPHONES PORTABLES PROVOQUE LE CANCER
- LES VACCINS COVID LIES AUX CAILLOTS OCULAIRES INCURABLES
- L'OMS DECLARE LA FIN DE L'URGENCE MONDIALE DE SANTE PUBLIQUE COVID-19
- LE MINISTRE POLONAIS DE LA SANTE DECLARE A PFIZER QUE LA LIVRAISON DE NOUVEAUX VACCINS EST "INUTILE"
- SPIKOPATHIE
- DETOX AUX PROTEINES DE POINTE
- DR ALEXANDRA HENRION CAUDE : SPIKOPATHIE : LA PATHOLOGIE DE LA PROTEINE DE POINTE
- LA PROTEINE DE POINTE DANS LES VACCINS A ARNM PROVOQUE UNE AGGLUTINATION INHABITUELLE DANS LA CIRCULATION SANGUINE
- RECETTES PREPPER : COMMENT FAIRE DU PAIN SANS FOUR COMME LE FAISAIENT LES PIONNIERS
- LE FBI SURPRIS EN TRAIN D'INFILTRER DES SALONS DE DISCUSSION EN LIGNE POUR LES TRAVAILLEURS QUI S'OPPOSENT VACCINS COVID
- LE NIH COMMENCE A TESTER DES «VACCINS» UNIVERSELS CONTRE LA GRIPPE A ARNM POUR LE RITUEL ANNUEL D'EDITION DE GENES
- LES PROTEINES DE POINTE DANS LES VACCINS COVID-19 PEUVENT CAUSER DES DOMMAGES AU CERVEAU, REVELE UN NEUROCHIRURGIEN
- LE SAFRAN PEUT COMBATTRE LE CANCER ET PROTEGER CONTRE LES DOMMAGES INDUITS PAR LA CHIMIOTHERAPIE
- BUDESONIDE EST UN TRAITEMENT PRECOCE TRES EFFICACE CONTRE LE COVID
- NE PAS CONSOMMER SUFFISAMMENT DE VITAMINE D AUGMENTE LE RISQUE DE DEVELOPPER PLUSIEURS MALADIES
- 9 FAÇONS DE RENDRE VOTRE MAISON ANTIALLERGIQUE
- COVID EST TERMINE, ET DANS SON SILLAGE, IL Y A SIX MILLIONS DE DECES EVITABLES, 36 MILLIONS DE DECES « VACCINAUX »
- LES FRAPPES DE MISSILES RUSSES DETRUISENT UN ENORME DEPOT DE MUNITIONS UKRAINIEN CONTENANT DES OBUS D'URANIUM APPAUVRI
- COMBIEN DE TEMPS L'ARNM ET LES PROTEINES DE POINTE DURENT-ILS DANS LE CORPS ?
- LA FDA ADMET ENFIN QUE LES FLAVONOLS DE CACAO AMELIORENT LA SANTE CARDIOVASCULAIRE
- LE GOUVERNEMENT AMERICAIN DIT QU'IL POSSEDE LES PENSÉES DE CHACUN, L'APPELANT "L'INFRASTRUCTURE COGNITIVE"
- CE N'EST PAS DRÔLE : DES COMEDIENS PAYES PAR LE CDC POUR S'OCCUPER DES VACCINS MORTS "SOUDAINEMENT" DANS LE MONDE ENTIER
- LES VACCINS COVID CONTIENNENT DE L'ADN DE SINGE VERT
- L'OMS ELIT LA COREE DU NORD COMMUNISTE A LA TETE DE SON CONSEIL D'ADMINISTRATION
- LA FDA AMERICAINE REVOQUE L'AUTORISATION D'UTILISATION D'URGENCE DU VACCIN J&J COVID-19
- GUIDE COMPLET POUR CALIBRER UN THERMOMETRE AVEC PRECISION
- FABRIQUER UN ACCUMULATEUR D’ORGONE
- SYMPTOME DE BAISSE DE TESTOSTERONE
- LA HAUSSE DES DECES CAUSEE PAR LE DEPLOIEMENT DU VACCIN COVID
- UN PROCES REVELE UNE LISTE SECRÈTE DE JOURNALISTES FAISANT DE LA PROPAGANDE AU NOM DU GOUVERNEMENT AMERICAIN
- COMMENT RECALIBRER VOTRE TENSIOMETRE A DOMICILE
- 13 MILLIONS DE PERSONNES DANS LE MONDE ONT ETE TUEES PAR DES VACCINS COVID
- UN LIEN ENTRE UNE FORTE CONSOMMATION DE MARIJUANA ET DES SYMPTOMES PSYCHOTIQUES
- THROMBOSE ET HERBES MEDICINALES
- LE CANNABIS EST LIE A LA MALADIE MENTALE
- SPIKE PROTEIN PERTURBE L'IMMUNITE CHEZ DES MILLIONS DE PERSONNES APRES UNE UNE VACCINATION
- LES SPIKE PROTEINES DU VACCIN COVID RESTE DANS LE CORPS, AFFECTE L'ADN
- LA FDA DECIDE QUE LES MEDECINS PEUVENT DESORMAIS PRESCRIRE DE L'IVERMECTINE POUR COVID-19
- 6 FAÇONS NATURELLES D'AUGMENTER LE FLUX SANGUIN VERS VOTRE CERVEAU
- LA N-ACETYLCYSTEINE, SUPER-ANTIOXYDANTE, AIDE A ELIMINER LES TOXINES DU CORPS A CAUSE DE L'ARNM
- LES DOCUMENTS DE PFIZER MONTRENT QUE SES INJECTIONS DE COVID-19 CONTIENNENT DE L'ARN MODIFIÉ AU LIEU DE L'ARN MESSAGER
- LE CDC ADMET ACCIDENTELLEMENT QUE LES MASQUES COURANTS SONT TOTALEMENT INUTILES CONTRE LE VIRUS COVID ET D’AUTRES INFECTIONS
- LES PREMIERS DECES DUS AU COVID EN AUSTRALIE ETAIENT TOUS ENTIÈREMENT VACCINÉS, SELON LES REGISTRES DE L'ÉTAT
- LES MASQUES N95 COVID EXPOSENT LES PORTEURS A DES NIVEAUX DANGEREUX DE PRODUITS CHIMIQUES TOXIQUES ET CANCERIGENES
- LES VACCINS CONTRE LE COVID-19 ONT CREE UNE ALLIANCE MORTELLE COMPOSEE DE GRAPHENE, D'ARNM ET DE NANOTECHNOLOGIES
- LA CURCUMINE CONTENUE DANS LE CURCUMA AFFAME LES CELLULES CANCEREUSES A MORT
- LA MOITIÉ DES PERSONNES « VACCINEES » CONTRE LE COVID CONTINUERONT A FABRIQUER DES PROTEINES DE POINTE MORTELLES POUR TOUJOURS
- VECTEUR DE TUER À DISTANCE 5G : LES SIGNAUX DES TELEPHONES PORTABLES PEUVENT ACTIVER LA LIBERATION DE CHARGES UTILES
- L'EXPOSITION AUX MICRO-ONDES ET AUX RAYONNEMENTS DES TELEPHONES PORTABLES PROVOQUE L'ACCUMULATION DE RADICAUX LIBRES
- LES SCIENTIFIQUES DE YALE PREVOIENT DE VOUS VACCINER DE FORCE AVEC LEUR NOUVEAU NANOPARTICULE AIR VAX
- LES CONTRACEPTIFS, LES STATINES, LES IPP ET LES MEDICAMENTS CONTRE L'HYPERTENSION SONT TOUS LIES A UN RISQUE ACCRU DE CANCER
- LES JEUNES PERSONNES VACCINEES CONTRE LE COVID-19 REÇOIVENT DE PLUS EN PLUS DE DIAGNOSTICS DE CANCER
- IMAGINEZ UN VACCIN « SI SUR » QU’IL FAUT ETRE MENACÉ POUR LE PRENDRE
- LE DOCTEUR SHERRI TENPENNY MET EN GARDE CONTRE PLUS DE DÉCÈS DUS AUX INJECTIONS DE COVID
- PFIZER RÉDUIT LES COÛTS APRES UNE BAISSE SIGNIFICATIVE DU RECOURS AU VACCIN COVID-19 ET A PAXLOVID
- REINER FUELLMICH, AVOCAT DU « DEUXIEME NUREMBERG »
- UNE INFIRMIERE CANADIENNE POURRAIT PERDRE SON PERMIS POUR AVOIR DENONCE LES MANDATS DE VACCINATION CONTRE LA COVID-19
- LES PREUVES SUGGERENT QU’IL N’Y A JAMAIS AUCUN ESSAI DE MÉDICAMENT POUR LE « VACCIN » COVID DE PFIZER
- UN EMINENT BANQUIER APPELLE SUISSE A « L’ARRESTATION » DE L’ENSEMBLE DU FORUM ECONOMIQUE MONDIAL
- L’ADULTÉRATION AVEREE DES VACCINS CONTRE LE COVID SIGNIFIE QU'IL EST POSSIBLE DE POURSUIVRE LES FABRICANTS DE VACCINS
- LA MOITIÉ DE TOUS LES JEUNES HOMMES QUI VACCINES ONT DEVELOPPE UNE MYOCARDITE ONT DESORMAIS DES LESIONS CARDIAQUES PERMANENTES
- LES DONNEES DU REVELENT QUE SEULEMENT 2 % DES AMERICAINS ONT REÇU DES VACCINS CONTRE LES NOUVELLES VARIANTES
- TOP 5 DES POSITIONS DE SOMMEIL POUR LES MAUX DE DOS
- QUELLES SONT LES MEILLEURES POSITIONS DE SOMMEIL POUR LES DOULEURS LOMBAIRES
- COMMENT FABRIQUER UN ACCUMULATEUR D'ORGONE POUR AMELIORER LA SANTE ET L'ENERGIE
- VOICI L'HISTOIRE VRAIE DU VIRUS DU SINGE SV40, CANCERIGENE, ET DE SON INCLUSION SECRETE DANS LES VACCINS CONTRE LA POLIO.
- UNE ETUDE MONTRE QUE LES ANTIOXYDANTS CONTENUS DANS LE RAISIN PEUVENT AMELIORER LA SANTE OCULAIRE
- LES STATINES SONT LE MEDICAMENT LE PLUS PRESCRIT AVEC DES AVANTAGES EXAGEREMENT VANTES ET DES EFFETS SECONDAIRES MINIMISES
- LES CITROUILLES PEUVENT AIDER A ATTENUER LA CARENCE EN VITAMINE A ET A PREVENIR LES CONSEQUENCES GRAVES DE LA ROUGEOLE
- BIG PHARMA RENOMME LES PRODUITS PHARMACEUTIQUES AYANT ECHOUE AVEC UN NOUVEAU « DOUBLE VACCIN » CONTRE LA GRIPPE - COVID
- LES HOPITAUX ONT MENTI SUR LA CAUSE DU DECES DES PATIENTS PENDANT LA PANDEMIE DE COVID-19
- COMMENT DORMIR AVEC LE NEZ BOUCHE : 25 CONSEILS POUR ACCELERER LA GUERISON ET MIEUX DORMIR
- COMMENT DEGAGER UN NEZ BOUCHE
- CES DEUX SUPPLEMENTS NUTRITIONNELS SIMPLES PEUVENT NEUTRALISER LEURS PROPRIETES NOCIVES
- UNE ETUDE REVELE QUE L'AVC POURRAIT ETRE TRANSMISSIBLE VIA DES TRANSFUSIONS SANGUINES
- LE GUIDE ESSENTIEL DE LA PLAQUE DE LA SCLEROSE EN PLAQUES
- NE RIEN FAIRE : UN « TRAITEMENT » INATTENDU ET POSSIBLE CONTRE LE CANCER QUI PEUT SAUVER DES VIES
- LA RECHERCHE MONTRE QUE LE CHAMPIGNON DE CRISTE DU LION PEUT LUTTER CONTRE LA DEMENCE ET LE DECLIN COGNITIF
- LES DOMMAGES CAUSES PAR LES VACCINS, TOUS VACCINS CONFONDUS, SONT BEAUCOUP PLUS REPANDUS QUE LES GENS NE LE PENSENT
- UNE EPIDEMIE DE PNEUMONIE CONTINUE DE BALAYER LE NORD ET L’EST DE LA CHINE
- UN ACCUEIL D'EVENEMENTS INDESIRABLES NOTABLES DU VACCIN CONTRE LE COVID-19, DEMONTRES PAR DES PREUVES
- UN ACCUEIL D'EVENEMENTS INDESIRABLES NOTABLES DU VACCIN CONTRE LE COVID-19, DEMONTRES PAR DES PREUVES
- 3 ALTERNATIVES AUX STATINES POURRAIENT CIBLER LA RACINE DE LA MALADIE CARDIAQUE
- LES VACCINS COVID N’ONT SAUVE AUCUN VIE TOUT EN TUANT BEAUCOUP, AVERTIT LES SCIENTIFIQUES
- LE BOIS DE SANTAL EST PLUS QU’UN SIMPLE ARBRE AU PARFUM DOUX ET APAISANT : C’EST L’UN DES BOIS LES PLUS PRECIEUX AU MONDE
- INSTRUMENTS PERSONNALISES
- MATERIEL DE DIAGNOSTIC
- FOURNITURE et CONSOMMABLE
- ABAISSE LANGUE
- LAMPE DE DIAGNOSTIC
- LAMPE FRONTALE
- MONITEUR MEDICAL
- OTOSCOPE
- OYMETRE DE POULS
- STETHOSCOPE
- TROUSSE
- TRANSFORMATEUR MURAL
- TENSIOMETRE ELECTRONIQUE BRAS
- TENSIOMETRE ELECRONIQUE POIGNET
- TENSIOMETRE CADRAN GEANT
- TENSIOMETRE DECONTAMINABLE
- TENSIOMETRE MANOBASSARD
- TENSIOMETRE MANOPOIRE
- TENSIOMETRE MULTI BRASSARDS
- AUDIOMETRES
- DERMATOSCOPE
- DIAGNOSTIC URINAIRE
- DOPPLER MEDICAL
- GLYCEMIE
- LOUPE BINOCULAIRE
- MICROSCOPE
- MIROIR LARYNGIEN
- OPHTALMOSCOPE
- OPTOMETRIE
- PODOSCOPE
- PROCTOLOGIE
- SPIROMETRE
- DEBITMETRE
- TYMPANOMETRE
- NEGATOSCOPE CLASSIQUE
- NEGATOSCOPE DE MAMOGRAPHIE
- NEGATOSCOPE DENTAIRE
- ACCESSOIRES POUR MICROSCOPE
- ACCESSOIRES POUR OXYMETRE
- AMPOULE
- REPARATION DE VOTRE EQUIPEMENT MEDICAL
- LA GARANTIE PERMANENTE DISPO
- CONSOMMABLES et FOURNITURES
- STERISALISATION
- ECLAIRAGE
- MOBILIER MEDICAL
- DIVANS D'EXAMEN HAUTEUR FIXE
- DIVANS D'EXAMEN HAUTEUR VARIABLE
- TABLES DE KINESITHERAPIE
- TABLES DE PEDIATRIE
- TABLES DIVERSES
- FAUTEUIL DE CARDIOLOGIE
- FAUTEUIL DE GYNECOLOGIE
- FAUTEUIL DE PODOLOGIE
- FAUTEUIL DE PRELEVEMENT
- FAUTEUIL DE REPOS et TRANSFERT
- FAUTEUIL ORL - EEG
- ARMOIRES
- CABINET MEDICAL INTEGRAL
- GUERIDON MEDICAL
- LAMPES D'EXAMEN
- MARCHEPIED
- MOBILIER MEDICAL DIVERS
- PARAVENT MEDICAL
- PIED A SERUM / PORTE SERUM
- MATERIEL D'URGENCE
- KINESITHERAPIE
- HYGIENE
- ECG
- TRAITEMENT
- MINI DIAGNOSTIC
- MISE EN FORME
- SAV
- EQUIPEMENTS DENTAIRES
- TRADUCTION DE VOS MODES D'EMPLOI ANGLAIS
- INFORMATIONS MEDICALES QUOTIDIENNES DANS LE MONDE
- L'ORGANISME DE REGLEMENTATION PHARMACEUTIQUE BRITANNIQUE N'A JAMAIS INSPECTE LES DONNEES DE L'ETUDE SUR LES VACCINS DE PFIZER
L'ORGANISME DE REGLEMENTATION PHARMACEUTIQUE BRITANNIQUE N'A JAMAIS INSPECTE LES DONNEES DE L'ETUDE SUR LES VACCINS DE PFIZER
Alors que les populations du monde entier sont confrontées à la contrainte de se soumettre à une « vaccination » basée sur le gène COVID-19, y compris l'exclusion de l'emploi et des soins médicaux , tandis que les rapports de décès suite à la vaccination montent en flèche , un scandale concernant la légitimité des processus d'autorisation des vaccins COVID se déroule .
EXCLUSIF AUX MÉDECINS POUR L'ÉTHIQUE COVID : Une deuxième demande d'accès à l'information visant à obtenir la transparence réglementaire a révélé que le régulateur médical britannique n'avait jamais inspecté les données des essais cliniques COVID-19 de Pfizer, rejoignant le régulateur australien pour tamponner le vaccin de Pfizer.

Suite à la révélation exclusive sur ce site Web qu'une demande d'accès à l'information au régulateur australien des médicaments (la Therapeutic Goods Administration ou TGA) a approuvé le vaccin à ARNm Pfizer-BioNtech en un temps record, mais n'a jamais vu les données au niveau du patient (IPD) de Pfizer, un autre le scandale réglementaire éclate.
L'histoire de la TGA a été publiée ici en juin, posant des questions de base concernant la probité de la TGA dans l'accomplissement de sa tâche la plus fondamentale : valider les données d'essais cliniques soumises par Pfizer. Au lieu de vérifier les données, la TGA a simplement tamponné le vaccin Pfizer, acceptant à première vue l' affirmation trompeuse de Pfizer selon laquelle leur produit montrait « 95 % d'efficacité pour prévenir l'infection au COVID-19 ».
Depuis lors, les données mondiales, en particulier au Royaume-Uni et en Israël (mais aussi dans des pays plus petits comme l'Islande et Gibraltar où les taux de vaccination approchent les 100 % mais les cas continuent d'augmenter), ont montré une efficacité décevante dans le monde réel, contrairement aux affirmations de Pfizer. Compte tenu des antécédents juridiques de fraude en matière de soins de santé de Pfizer, il était impératif que les régulateurs des médicaments vérifient les données de soumission des fabricants de médicaments avant l'approbation du vaccin COVID.
La TGA n'a pas réussi à le faire, mais qu'en est-il de l'autre organisme de réglementation des médicaments tenu en haute estime dans le monde – la MHRA du Royaume-Uni ?
Doctors for Covid Ethics peut révéler que la MHRA n'a jamais non plus validé les données des essais de Pfizer.
Obfuscation de la liberté d' information
Le 7 e Juin 2021, un accès à l'information (accès à l' information) demande a été soumise à la MHRA, cherchant la documentation relative à l'autorisation temporaire de Pfizer (BNT162b2) et AstraZeneca (ChAdOx1) Covid-19 vaccins. Plus précisément, la FOI (FOI 21/632) a demandé :
- Tout document demandant l'accès du promoteur [Pfizer et AstraZeneca] aux données brutes (données anonymisées au niveau du patient ou données équivalentes au niveau du patient).
- Confirmation quant à savoir si la MHRA détient les données au niveau des patients (environ 70 000 enregistrements) de ces applications ou si celles-ci ont été restreintes d'accès ou d'évaluation par le promoteur. S'ils ont été fournis, le format dans lequel ces enregistrements ont été fournis et comment ils ont été hébergés à la MHRA (par exemple, base de données papier ou électronique - spécifiez le format tel que MySQL, bases de données MsSQL, csv, fichiers Excel).
- Tout document confirmant qu'un processus d'analyse des données brutes du sponsor a été entrepris, et le résultat de ce processus (par exemple, procès-verbal de réunion ou équivalent), y compris les qualifications (et les noms, le cas échéant) du comité (le cas échéant) qui a entrepris le examen des données brutes.
Plutôt que de répondre à l'une des questions ou de fournir de la documentation, la MHRA a répondu par des généralités concernant le processus habituel et a délégué ses responsabilités à Public Health England, en créant un réseau de déviation enchevêtré. Voir la réponse initiale de la MHRA à la demande de FOI ici , et la réponse de suivi du demandeur de FOI cherchant des réponses spécifiques plutôt que l'obscurcissement ici .
En plus de citer la pratique courante et en notant que « le parrain » à savoir Pfizer , « a eu accès aux données brutes », la MHRA a dirigé le demandeur d'accès à l' information à une réunion du comité plus tôt avec la Commission des médicaments à usage humain (CHM), tenue le 24 e Décembre 2020. Le procès-verbal de cette réunion révèle que le CHM avait été informé : « Les résultats de l' analyse MHRA des données brutes de l'analyse intermédiaire ont montré une VE de 91 % (IC 63, 98) dans la période allant du jour 14 après la première dose à lorsque la dose 2 a été administrée. Les résultats d'une analyse indépendante par Public Health England de l'ensemble de données Pfizer complet ont également été discutés. »
Un document résumant la réunion du CHM est ici .
Cependant, sur la base de leurs réponses FOI, la MHRA semble n'avoir analysé aucune donnée brute du tout. Dans un courriel daté du 29 e Juillet 2021, suite à la deuxième demande de l' assurance que la MHRA avait mené sa propre analyse des données du demandeur d'accès à l' information, la MHRA a déclaré:
« Afin de clarifier nos déclarations précédentes, nous pouvons vous confirmer ce qui suit : Les données au niveau des patients issues des études cliniques sont soumises à la MHRA avec toutes les demandes d'autorisation de nouveaux médicaments. Aucune autorisation n'a été donnée au promoteur, car aucune n'était requise. « La MHRA a ensuite dirigé le demandeur vers des publications publiques concernant l'autorisation du vaccin COVID sur les sites Web du gouvernement.
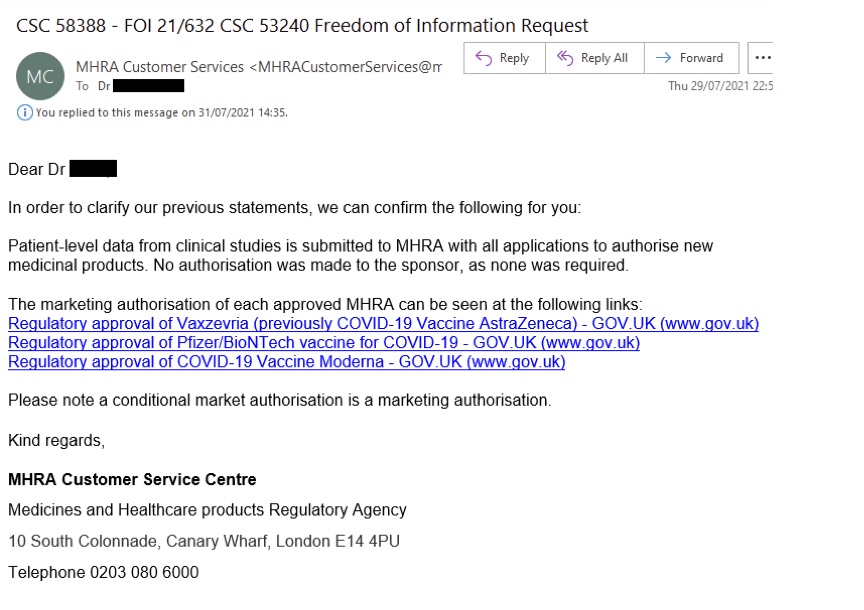
Cette réponse était manifestement incompatible avec le procès - verbal CHM du 24 e Décembre.
Le grand mensonge
Étant donné que la MHRA avait dévié à la réunion CHM comme preuve que « les données d'essais cliniques ont été analysés comme ils le seraient pour une autorisation de mise sur le marché », une nouvelle demande d' accès à l' information a été présentée le 31 er Juillet 2021 - cette fois pour la santé publique en Angleterre . La deuxième demande de FOI concernait la prétendue « analyse indépendante… de l'ensemble de données Pfizer complet » par PHE, comme cité lors de la réunion du CHM.
La réponse a été rapide et négative.

La réponse de PHE poursuit en indiquant « Conformément à la section 1 (1) (a) de la loi sur la liberté d'information, PHE peut confirmer qu'elle ne détient pas ces informations . Ce n'est pas le cas que PHE ait eu accès à l'ensemble de données Pfizer complet . »
En d'autres termes, la MHRA (l'organisme britannique de réglementation des médicaments chargé d'assurer la sécurité des nouveaux médicaments) n'a pas analysé les données de Pfizer elle-même. En outre, ils ont affirmé avoir confié ce travail à Public Health England, qui a déclaré catégoriquement qu'ils n'avaient pas accès aux données, et encore moins effectué la validation ou l'analyse des données.
Le document complet relatif à la FOI de Public Health England est disponible ici .
L'essentiel est qu'il s'agit du deuxième des quatre grands régulateurs de médicaments (MHRA, TGA, EMA, FDA) qui n'ont jamais inspecté ni évalué la validité des données « miracle » de Pfizer.
Ce qui soulève la question : qui, en dehors de Pfizer, a vérifié et analysé les données d'essai de Pfizer ? Pourquoi le public devrait-il croire Pfizer sur parole sur les résultats de ses propres enquêtes, alors que des dizaines de milliards de dollars de profits sont en jeu ? Quel est le véritable rôle des régulateurs médicaux si leur approche de « toute autorisation de mise sur le marché » consiste à sous-traiter la validation des données à un organisme qui n'a jamais reçu, et encore moins inspecté, les données du fabricant ?
Et pourquoi la Commission on Human Medicines a-t-elle dit que Public Health England avait entrepris une « analyse indépendante… de l'ensemble de données Pfizer complet » alors que ce n'était pas le cas ?
Les réponses à ces questions sont essentielles pour la santé et la sécurité publiques des vaccins COVID-19. La plausibilité des affirmations de Pfizer concernant leurs données d'essai avait déjà été remise en question avant ces résultats de FOI, sur la base à la fois d'incohérences numériques et d'affirmations scientifiquement indéfendables dans la documentation de Pfizer sur leurs conclusions.
Une analysepar des professeurs d'immunologie, de biochimie, de toxicologie et de pharmacologie, par exemple, a détaillé « des allégations et des contradictions peu probables » dans les rapports d'essais cliniques de Pfizer. Cela comprend l'apparition soudaine et uniforme de l'immunité chez tous les receveurs du vaccin le 12e jour suivant l'injection, ce qui n'est « pas du tout un résultat biologiquement plausible ». De plus, selon la documentation de Pfizer, l'immunité d'apparition soudaine s'est produite avant, et non après, l'apparition d'anticorps neutralisants, dont les niveaux n'ont commencé à augmenter que 9 jours plus tard, atteignant des niveaux maximaux le 28e jour, plus de deux semaines après que l'immunité clinique aurait été établie. in. D'autres divergences ont été notées numériquement, avec différentes analyses des mêmes données par Pfizer contenant des nombres incohérents qui « ne peuvent probablement pas être conciliés ; il faut être faux. Puisque, comme discuté,
Avec des anomalies aussi flagrantes, contre l'histoire de Pfizer d'avoir établi des milliards d'amendes pénales et de règlements pour fraude et produits médicaux dangereux , y compris la conduite d'essais cliniques non autorisés, et à la lumière du manque de transparence réglementaire et des échecs de la surveillance réglementaire documentés ici, COVID les receveurs du vaccin ont le droit de demander : Pfizer a-t-il fabriqué ses données pour le vaccin à ARNm COVID-19 ?


