Aucun produit

POURQUOI LA PROTEINE SPIKE PROVOQUE DES CAILLOTS SANGUINS ANORMAUX, 200 SYMPTOMES
CAILLOTS ETRANGES
Depuis la mi-2021, des caillots sanguins inhabituels et longs trouvés dans les vaisseaux des patients atteints de COVID-19 et des receveurs de piqûres ont été signalés dans le monde entier.

«En tant qu'embaumeurs, nous voyons d'étranges caillots depuis l'épidémie de COVID. Ces caillots sont très caoutchouteux et très longs lorsqu'ils sortent des veines que nous utilisons lors de la procédure d'embaumement. Ils ressemblent vraiment à des vers de terre. Je n'ai jamais vu cela dans ma carrière jusqu'à présent », a déclaré Larry Mills, un embaumeur agréé et directeur de funérailles dans l'État de l'Alabama, à Epoch Times.
D'autres embaumeurs ont confirmé des découvertes similaires et ont parlé sous couvert d'anonymat.
Richard Hirschman, directeur de pompes funèbres et embaumeur de l'Alabama depuis 2001, a été l'un des premiers à attirer l'attention sur ce phénomène. Il a dit qu'avant le COVID, peut-être 5 à 10% des personnes avaient ces caillots. Maintenant, plus de la moitié des corps qu'il voit en ont.
Un embaumeur, agréé depuis 2001, a déclaré dans une interview : « Je peux vous dire avec certitude que les caillots que Richard a montrés en ligne sont un phénomène dont je n'ai pas été témoin avant probablement le milieu de l'année dernière. C'est à peu près tout ce que j'ai à dire à ce sujet. Je ne sais pas ce qui cause les caillots, mais ils ont apparemment commencé à apparaître vers le milieu de 2021. »
D'où viennent ces étranges caillots fibreux ? Comment se forment-ils ?
UNE CONDITION AVEC PLUS DE 200 SYMPTOMES
Les médecins ont compris, depuis les premiers jours de la pandémie, que le COVID-19 n'est pas seulement une maladie pulmonaire, mais aussi une maladie endothéliale et vasculaire.
Les médecins ont résumé une liste d' observations cliniques inhabituelles de COVID-19, y compris, mais sans s'y limiter, des patients gravement hypoxiques (faible teneur en oxygène) malgré une compliance pulmonaire relativement normale lors de l'examen, des complications thrombotiques et des résultats d'autopsie cohérents de caillots sanguins (thrombi) dans la microcirculation de le poumon.
Après une infection aiguë au COVID-19, plus de 200 symptômes persistants différents ont été signalés pendant une longue période de COVID, qui peut persister pendant environ 6 à 24 mois .
C'est peut-être le plus grand nombre de symptômes rapportés avec une condition médicale jusqu'à présent.
Les symptômes les plus fréquents sont l'essoufflement, la fatigue, le brouillard cérébral, les dysfonctionnements cognitifs, les douleurs musculaires (myalgies), les troubles du sommeil et l'anxiété ou la dépression.
La nature chronique et récurrente du long COVID est principalement causée par un dérèglement immunitaire, une hyperinflammation, un stress oxydatif et un dysfonctionnement mitochondrial.
Mais comment est-ce possible, et pourquoi ? Des indices ont émergé depuis 2020.
CAILLOTS SANGUINS PROVOQUANT DES SYMPTOMES
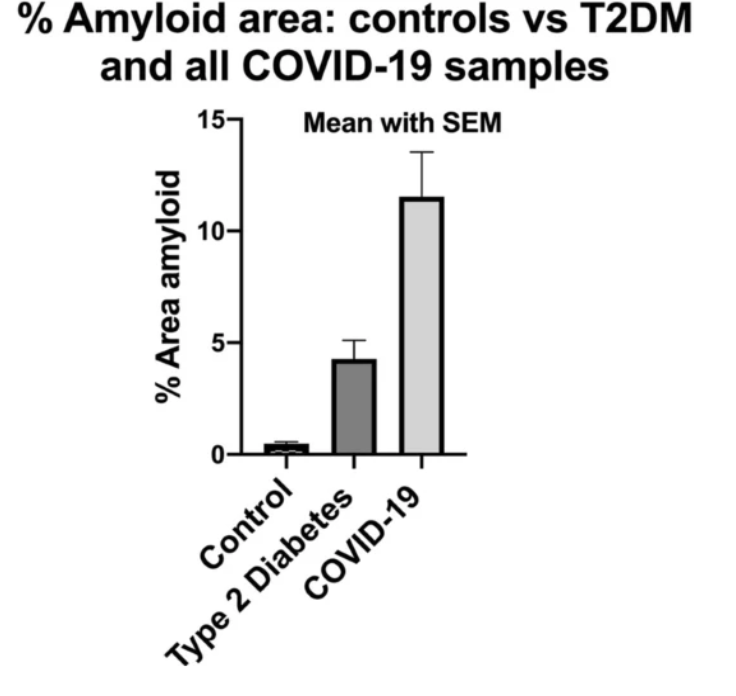
En novembre 2020, un rapport faisant état d'une augmentation des microcaillots chez les patients COVID-19 par rapport aux patients sains ou diabétiques pourrait raisonnablement expliquer l'essoufflement, la fatigue et le syndrome de malaise post-effort.
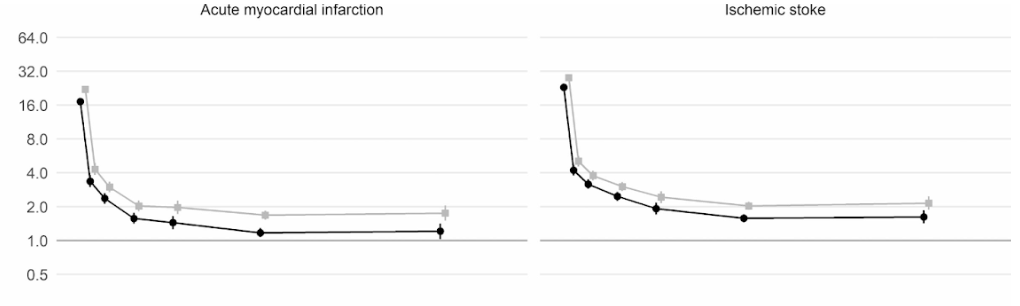
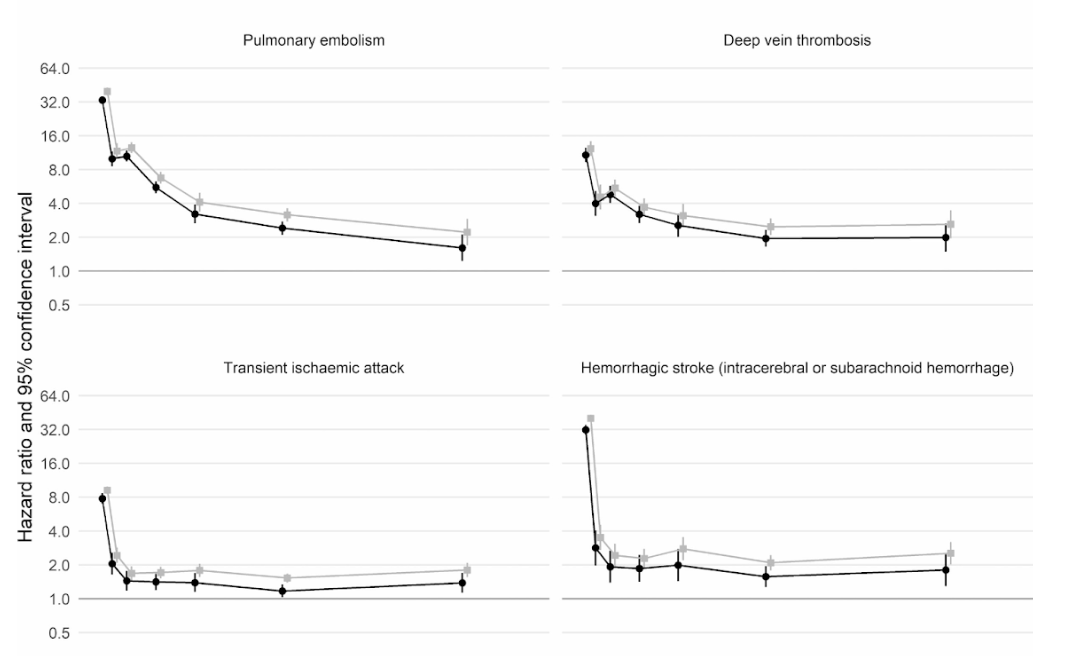
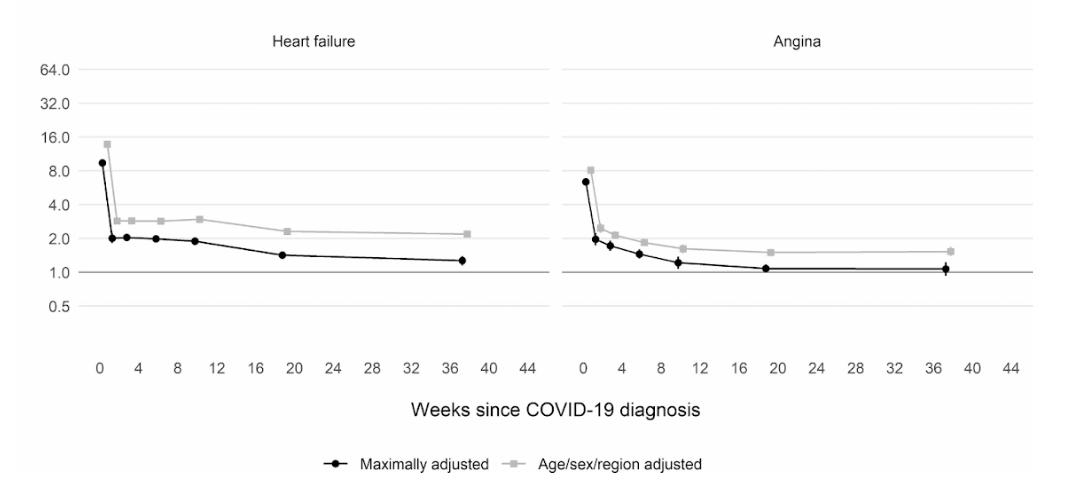
De plus, une étude de cohorte britannique à grande échelle basée sur 48 millions d'adultes en Angleterre et au Pays de Galles a révélé que dans la première semaine après un diagnostic de COVID-19, le risque de caillot sanguin artériel était près de 22 fois plus élevé que chez une personne sans COVID-19, et 33 fois plus élevé pour une condition de caillot veineux.
Un caillot artériel est le type qui pourrait provoquer une crise cardiaque ou un accident vasculaire cérébral ischémique en bloquant le flux sanguin vers le cœur ou le cerveau.
Cela a conduit à environ 10 500 cas supplémentaires de problèmes liés aux caillots , soit environ 7 200 crises cardiaques ou accidents vasculaires cérébraux supplémentaires et 3 500 cas supplémentaires d'embolie pulmonaire, de thrombose veineuse profonde ou d'autres problèmes veineux.
Même si ce risque chute fortement à moins de quatre fois plus élevé qu'une personne sans COVID au cours de la deuxième semaine, il reste élevé (2x) même jusqu'à 49 semaines après le diagnostic initial. Cela est particulièrement vrai en ce qui concerne le risque de thrombose veineuse profonde. Ce sont des caillots qui se forment dans les grosses veines.
SPIKE PROTEIN : LE PREMIER DOMINO RENVERSE
Le sang est un liquide qui circule sous pression dans les vaisseaux sanguins de tout notre corps, comme l'eau qui coule dans la maison et que l'on utilise ensuite pour se doucher, faire la vaisselle, etc.
Suite à une lésion vasculaire, tout sang « qui s'écoule » doit être rapidement transformé en un gel (un « caillot ») pour combler le trou et minimiser les pertes de sang supplémentaires.
Normalement, la partie plasmatique du sang contient une collection de protéines solubles qui agissent ensemble dans une série d'événements d'activation enzymatique qui entraînent la formation d'un caillot de fibrine. Ce processus est protecteur, car il prévient les pertes de sang excessives à la suite d'une blessure.
Malheureusement, le mécanisme de coagulation du sang peut également entraîner la formation de caillots sanguins indésirables dans les vaisseaux sanguins (thrombose pathologique), par exemple une crise cardiaque ou un accident vasculaire cérébral, qui sont tous deux l'une des principales causes d'invalidité et de décès dans le monde.
La manière dont COVID-19 provoque des caillots sanguins anormaux a suscité de nombreuses discussions depuis le début de 2020.
Il semble que la protéine de pointe unique du virus déclenche la cascade via de nombreuses voies « non traditionnelles ».
L'invasion directe des cellules épithéliales par la protéine de pointe est le premier domino renversé.
Les effets en cascade ultérieurs provoquent finalement la coagulation du sang.
LA PROTEINE DE POINTE ALTERE LES CELLULES EPITHELIALES
Le SRAS-CoV-2 pénètre dans nos cellules via un récepteur protéique appelé l'enzyme de conversion de l'angiotensine 2 (ACE2).
Les cellules endothéliales (CE) expriment une abondance d'ACE2. Les CE résident sur la surface interne de chaque vaisseau sanguin dans tout notre corps, ce qui en fait une cible directe de l'infection virale.
Des études ont montré que la protéine de pointe elle-même peut endommager la structure et la fonction des EC, notamment en altérant les mitochondries et en régulant à la baisse la molécule protectrice ACE2 sur les EC.
Les chercheurs ont observé que les parties S1 et S2 de la protéine de pointe peuvent induire les CE humaines à exprimer un pic de cytokines pro-inflammatoires (IL6, IL1B, TNF-alpha et les chimiokines CXCL1 et CXCL2).
Par la suite, la libération de cytokines initie la molécule de type interrupteur (E-sélectine) sur la membrane des cellules endothéliales, leur permettant de se fixer aux cellules immunitaires, initiant ainsi les processus pathologiques ultérieurs.
Des études supplémentaires sur la protéine de pointe ont montré qu'elle activait l'inflammation EC dépendante des voies de signalisation de l'intégrine ⍺5β1 et NF-κB et de l'expression ultérieure des molécules d'adhésion des leucocytes.
Les cytokines sont de petites protéines sécrétées par les cellules (principalement les lymphocytes T et les macrophages). Ils ont de nombreux noms spécifiques et servent de communicateur entre les cellules (signalisation cellulaire) pour une action ultérieure. Les cytokines sont les « facteurs » du corps qui se connectent et communiquent entre les cellules.
La protéine de pointe peut induire une rupture des protéines de connexion entre les cellules endothéliales des vaisseaux sanguins , ce qui perturbe l'intégrité et la fonction de nos vaisseaux sanguins.
Les CE cérébrales expriment également fortement ACE2. La protéine Spike a des effets toxiques similaires sur les CE cérébrales , induisant des symptômes neurologiques (brouillard cérébral, déclin cognitif).
LES PROTEINES DE POINTE DECLENCHENT LA CASCADE DE COAGULATION
De nombreuses autres cellules, y compris les cellules épithéliales pulmonaires, les entérocytes tapissant l'intestin grêle et les péricytes cardiaques, expriment toutes l'ACE2.
Les protéines de pointe n'activent pas seulement les cellules épithéliales (CE) et favorisent l'inflammation localisée. Ils favorisent également l'inflammation systémique car l'ACE2 est presque partout dans nos principaux organes et tissus.
Par conséquent, davantage de gènes pro-inflammatoires sont exprimés. De plus en plus de cellules immunitaires sont attirées et envoyées vers les tissus lésés ou infectés (vaisseaux pulmonaires, cardiaques, intestinaux, etc.).
Un certain nombre d'événements ultérieurs contribuent collectivement à la cascade de coagulation :
- Inflammation des épithéliums médiée par le complément ( endothélialite ) : les protéines de pointe ancrées sur les CE ACE2 activent la voie du complément et la cascade de la coagulation, entraînant une endothélialite systémique (lésion pulmonaire) et un état procoagulant (tendance à développer des caillots sanguins).
- Au fur et à mesure que le complément détruit l'endothélium, le facteur procoagulant von Willebrand (vWF) et le FVIII sont libérés. Une augmentation significative du vWF peut former des multimères qui favorisent la croissance du thrombus . Le vWF est sécrété principalement par les cellules endothéliales et par les granules a des plaquettes (dérivées des mégacaryocytes). Ceci est comparable à la ficelle dans les "perles et ficelle" d'un collier où les perles représentent des plaquettes.
- Tempête de plaquettes : Les plaquettes sont un petit fragment des mégacaryocytes. Les anaphylatoxines du complément C3a et C5a activent les plaquettes et augmentent la production de facteur tissulaire favorisant davantage un état de formation de coagulation.
Les récepteurs ACE2 sont présents sur les plaquettes, ce qui peut contribuer à l'agrégation plaquettaire massive, qui est une caractéristique de l'infection grave au COVID-19. - L'activation des neutrophiles entraîne la formation de pièges extracellulaires de neutrophiles (NET), un processus parfois appelé NETosis, qui contribue à la thrombose .
- Les lésions de la CE sont aggravées par l'activation du récepteur de type péage (TLR) par la reconnaissance de l'ARN viral, avec pour résultat une augmentation de la production d'espèces oxydatives réactives (ROS) . L'augmentation des ROS régule à la hausse l'expression du vWF .
- La protéine de pointe peut induire l'expression et la sécrétion d' une série de protéines de coagulation qui se répercutent en cascade dans le processus de coagulation, notamment le facteur (F)-V, la thrombine et le fibrinogène pour favoriser le processus de coagulation.
LA PROTEINE DE POINTE DEREGULE LE RAAS, AGGRAVANT L'ETAT DE COAGULATION
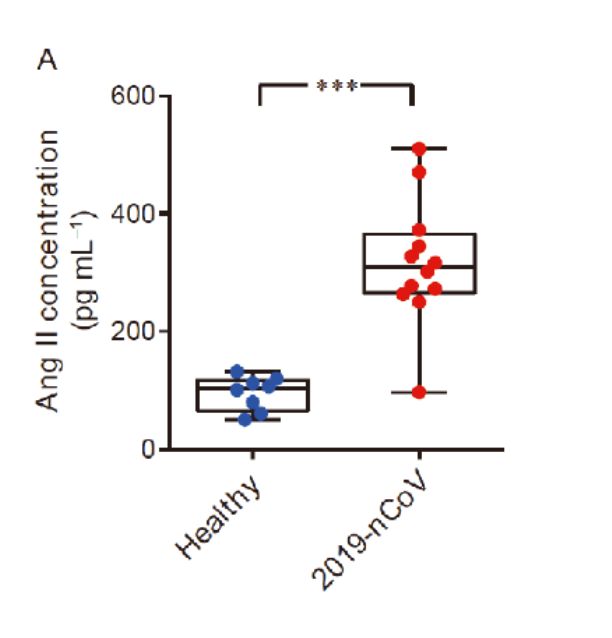
En raison de l'interaction directe de la protéine de pointe avec l'expression de l'ACE2, les patients COVID-19 ont montré un taux élevé d'angiotensine II sérique indiquant une dérégulation du système RAA (système rénine angiotensine aldostérone, ou RAAS).
Traditionnellement, les gens pensent que l'angiotensine II est une neurohormone qui stimule la constriction des cellules musculaires lisses vasculaires et est responsable de l'équilibre salin et hydrique.
Cependant, de nombreuses études ont soutenu l'idée que l'angiotensine II est capable d'initier et de réguler positivement les réponses inflammatoires , aggravant ainsi l'état de coagulation.
Dans une réponse immunitaire régulée et auto-limitée, ces mécanismes aident à calmer la blessure locale, avec une guérison ultérieure et un retour à un état EC de repos.
Cependant, pour les patients prédisposés au COVID-19 ou les personnes vaccinées, les facteurs renforçant la formation de caillots sont bien plus lourds que les mécanismes de guérison, qui conduisent tous à une cascade thrombotique croissante .
Voici un bref résumé de la première scène de l'histoire du caillot : perturbation endothéliale induite par un pic, libération massive de vWF, tempête plaquettaire ultérieure, régulation à la hausse induite par l'hypoxie et activation du vWF, réseau fibreux à partir de pièges extracellulaires de neutrophiles (NET), ainsi comme une augmentation du taux d'angiotensine II, le tout s'additionnant pour initier la thrombogenèse.
C'est ainsi que le mécanisme de coagulation se produit. De plus, la deuxième scène à venir joue un autre rôle central dans toute l'histoire.
Un vaccin COVID ordonne aux cellules de produire de grandes quantités de protéines de pointe. Les processus biochimiques et physiologiques normaux sont « détournés » afin de fabriquer une quantité anormale de ces protéines de pointe.
Ces quantités anormales de protéines de pointe ont des effets directs plus surprenants sur les caillots.
LES PROTEINES DE POINTE PERTURBENT DIRECTEMENT LE MECANISME DE DISSOLUTION DES CAILLOTS
Chez une personne normale en bonne santé, le corps va, en présence d'un caillot sanguin, le décomposer par un processus de fibrinolyse. Il s'agit d'un mécanisme naturel de guérison et d'équilibrage pour prévenir une abondance de caillots sanguins.
Au cours de ce processus, l'activateur tissulaire du plasminogène (TPA, provenant de l'endothélium) aide le plasminogène à se transformer en plasmine, puis à générer des d-dimères (un petit fragment de protéine laissé lors de la dissolution d'un caillot sanguin).
Il a été découvert que le fibrinogène dans le sang peut coaguler en une forme « amyloïde » anormale de fibrine qui (comme d'autres amyloïdes et prions riches en bêta) est relativement résistante à la protéolyse (fibrinolyse).
Cela se manifeste fortement dans le plasma pauvre en plaquettes (PPP) des individus atteints de COVID long. Les microcaillots amyloïdes de fibrine étendus peuvent persister.
Dans une étude exceptionnelle de Grobbelaar publiée dans Bioscience Reports en août 2021, le biomarqueur S1 (ou la partie intrusive de la protéine de pointe) peut à lui seul induire une résistance de la fibrine à la fibrinolyse , conduisant à la formation de microcaillots sans opposition.
Lorsque la protéine de pointe S1 a été ajoutée à un PPP sain, cela a entraîné des modifications structurelles de la fibrine β et γ (ogène), du complément 3 et de la prothrombine. Ces protéines étaient substantiellement résistantes à la trypsinisation en présence de la protéine de pointe S1.
Par conséquent, les résultats suggèrent que la présence de protéines de pointe en circulation peut contribuer à l'état d'hyper coagulation et peut entraîner une altération substantielle du processus de dissolution du caillot.
Une telle déficience lytique peut entraîner les gros micro-caillots persistants que les gens ont signalés et qui ont été trouvés dans des échantillons de plasma de patients COVID-19.
Ces micro-caillots bloquent les capillaires, et limitent ainsi le passage des globules rouges, et donc les échanges d'oxygène, qui peuvent en fait sous-tendre la majorité de ces symptômes.
LES PROTEINES DE POINTE FORMENT UNE SUBSTANCE SEMBLABLE A L'AMYLOÏDE
De plus, à la surprise générale, les protéines de pointe sont identifiées pour présenter sept séquences amyloïdogènes et sont capables de former des substances de type amyloïde .
En d'autres termes, ces protéines de pointe sont similaires aux substances de type bêta-amyloïde ou tau ou alpha-synucléine qui peuvent provoquer une perte neuronale chez les patients atteints de la maladie d'Alzheimer ou de Parkinson.
Leur structure facilite la formation de structures liées en forme de cordes plus serrées avec une torsion longitudinale ainsi qu'une liaison croisée, formant une structure de type fibreuse visible au microscope.
Les chercheurs ont découvert que les échantillons de plasma de patients atteints de COVID depuis longtemps contiennent encore de gros dépôts anormaux (amyloïdes) (microcaillots), qui résistent à la fibrinolyse (par rapport au plasma des témoins et du diabète), même après la trypsinisation (dissociation cellulaire après qu'une enzyme décompose les protéines) .
Après une seconde trypsinisation, les dépôts persistants de culots (microcaillots) ont été solubilisés. Diverses molécules inflammatoires ont considérablement augmenté à la fois dans le surnageant et piégées dans les dépôts de granulés solubilisés de COVID-19, par rapport à celle des échantillons témoins.
Une augmentation substantielle de l'α(2)-antiplasmine (α2AP), de diverses chaînes de fibrinogène, ainsi que de l'amyloïde sérique A (SAA) qui ont été piégés dans les dépôts solubilisés résistants aux fibrinolytiques, a été particulièrement intéressante.
La formation anormale importante de microcaillots amyloïdes résistants à la fibrinolyse, l'augmentation de l'α2AP et la poussée de molécules inflammatoires en phase aiguë peuvent donc être des contributeurs centraux à la fois à l'infection au COVID-19 et au syndrome lié au vaccin COVID.
LA PROTEINE DE POINTE INHIBE UN AUTRE MECANISME ANTI-CAILLOT
La protéine de pointe n'est qu'une surprise après l'autre.
Il a été rapporté que la protéine de pointe peut inhiber de manière compétitive les liaisons de l'antithrombine et du cofacteur II de l'héparine à l'héparine , provoquant une augmentation anormale de l'activité de la thrombine (coagulation).
Les protéines de pointe du SRAS-CoV-2 à une concentration similaire (~ 10 μg/mL) à la charge virale chez les patients gravement malades peuvent directement provoquer une coagulation sanguine et une thrombose dans le modèle du poisson zèbre.
Pour résumer, ces effets négatifs inattendus de la protéine de pointe sur le processus de dissolution des caillots sanguins, ainsi que sa nature amyloïde, peuvent tous être les principaux facteurs contributifs aux caillots fibreux anormaux et longs observés dans les conditions liées au COVID.
LA PROTEINE DE POINTE EST LE PISTOLET FUMANT
Il existe des preuves cliniques que la protéine de pointe du SRAS-CoV-2 a été détectée dans des caillots récupérés chez des patients atteints de COVID-19 ayant subi un AVC ischémique aigu et un infarctus du myocarde.
Des recherches récentes menées par des cardiologues de l'Université du Colorado mettent en lumière le rôle crucial de la protéine de pointe dans la pathologie des blessures liées au vaccin COVID et COVID.
Ils ont analysé sept patients COVID-19 et six patients vaccinés par ARNm présentant une lésion myocardique et ont trouvé des altérations presque identiques dans les modèles de profilage génétique qui les prédisposeraient à l'état de coagulation , à l'inflammation et au dysfonctionnement du myocarde.
En d'autres termes, que la myocardite soit causée par le virus ou le vaccin, l'expression des gènes responsables de l'état prothrombotique en réponse à la protéine de pointe, à l'inflammation et au dysfonctionnement du myocarde, a présenté des changements similaires.
D'après l'analyse des gènes, le COVID-19 et les lésions vaccinales post-ARNm ont un mécanisme moléculaire commun.
Le modèle de gènes modifié comprend une régulation à la baisse dans ACE2, le rapport ACE2/ACE, AGTR1 et ITGA5, et une régulation à la hausse dans ACE et F3 (facteur tissulaire).
Ce qui est plus alarmant et non signalé auparavant, c'est que la thrombose microvasculaire a été découverte chez des patients post-vaccinés, ce qui indique que la protéine de pointe elle-même est capable de déclencher des caillots sanguins chez les patients sensibles.
Le sommet de l'iceberg
Sur la base de la relation causale entre les vaccins ChAdOx1-S (le vaccin contre l'adénovirus COVID d'AstraZeneca) et la thrombose avec syndrome de thrombocytopénie, les informations sur le produit pour ChAdOx1-S ont été mises à jour pour inclure la thrombose avec syndrome de thrombocytopénie comme effet secondaire très rare.
Cela a été nommé thrombocytopénie thrombotique immunitaire induite par le vaccin (VITT), en raison du fait que chez presque tous les patients de ces rapports, des niveaux élevés d'anticorps dirigés contre le facteur plaquettaire 4 (PF4) - complexes de polyanions ont été identifiés dans leur corps.
Ces caillots sanguins inhabituels associés à une thrombocytopénie ont été rapportés principalement chez des femmes âgées de moins de 60 ans. En conséquence, plusieurs pays européens ont restreint l'utilisation des vaccins contre les adénovirus dans les groupes d'âge plus jeunes.
Ce risque a récemment été systématiquement analysé dans une étude de cohorte en réseau international de cinq pays européens et des États-Unis, confirmant un risque accru de thrombocytopénie combiné de 30 % après une première dose du vaccin ChAdOx1-S, ainsi qu'une tendance à un risque accru de thrombose veineuse avec syndrome de thrombocytopénie après Ad26.COV2.S (le vaccin Janssen COVID) par rapport à BNT162b2 (le vaccin Pfizer-BioNTech COVID).
Cependant, ce n'est peut-être que la pointe de l'iceberg. De nombreux autres événements pourraient être attribués aux problèmes de coagulation, notamment la mort subite, les événements cardiovasculaires, la mort cardiaque, les accidents vasculaires cérébraux, les invalidités, les événements thrombotiques, etc.
Les vaisseaux sanguins sont dans tous nos organes. Les problèmes vasculaires pourraient expliquer un large éventail de symptômes allant du dysfonctionnement au léger déclin de notre cerveau, de notre cœur, de nos poumons et de nos extrémités.

